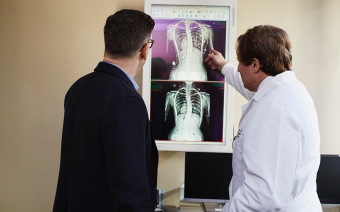
Он сделан по технологии конвертоплана, то есть взлетает вертикально
Резидент «Сколково» — компания «Аэроксо» — вошел в пятерку призеров второго тура Go Fly Challenge, конкурса, который спонсирует Boeing.
Объявленный в 2017 году конкурс — первый в своем роде. Участникам предложили ни много ни мало создать свою версию персонального летательного аппарата, то есть воздушного судна,которое в будущем позволит каждому человеку свободно перемещаться по воздуху! Оказалось, такой конкурс давно назрел, ведь откликнулось более 600 команд из 101 страны мира. На первом этапе достаточно было подать чертежи или подробное описание проекта, а вот на втором потребовался прототип. Победителями стали три команды из США, одна из Голландии и российская «Аэроксо» (резидент «Сколково»).
Жюри понравилась неожиданная и смелая концепция россиян — авиабайк (в компании его называют «ЭРА Авиабайк»).
« Это индивидуальное средство передвижения по воздуху, только не как автомобиль, а как мотоцикл,— объясняет Владимир Спинко, операционный директор компании “Аэроксо” и капитан одноименной команды на конкурсе Go Fly Prize Challenge.— Мы рассчитываем, что нашими первыми клиентами будут байкеры. Наш лозунг: “Аэроксо” — это супербайк, которому не нужно дорог».
Авиабайк российской команды будет летать на высоте от 50 м до 300 м со скоростью 150–160 км/ч. При этом в летательном аппарате нет кабины — он абсолютно открыт, как настоящий мотоцикл. «Ребята на обычных байках носятся под 200 км/ч,— говорит Владимир Спинко.— Зато какие впечатления!»
«Главное преимущество, что в горизонтальном полете аппарат движется при помощи подъемной силы крыла,— подчеркивает Владимир Спинко.— По аэродинамике такой полет в пять раз эффективнее, чем на вертикально расположенном моторе, то есть за счет подъемной силы винта».
Первую детальную разработку конвертоплана подготовили в 1938 году в Германии. Затем было много проектов, но в реальной жизни используется лишь один — Bell V-22 Osprey, состоящий на вооружении ВМС и ВВС США. «Наша компания была создана для разработки и производства конвертопланов,— рассказывает Владимир Спинко.— У нас своя запатентованная эргономическая схема, которую разработал основатель и главный изобретатель “Аэроксо” Элдар Разроев. До конкурса Go Fly Challenge мы производили конвертопланы до 30 кг и участвовали с ними в авиасалонах МАКС-2015 и 2017, других выставках. И когда объявили конкурс, мы подумали, что будет здорово сделать следующий шаг, создав аппарат весом 300–350 кг — такова максимальная взлетная масса нашего авиабайка. Наш плюс в том, что многие решения мы отработали на беспилотниках малых размеров.
Ключевая наша разработка — это система управления. Ведь главная проблема конвертопланов — переход из зависания на крейсерский режим полета. Созданная нами система управления позволяет сделать этот переход очень плавным».
Еще одно достоинство авиабайка «Аэроксо» — использование принципа распределенной электрической тяги (DEP — distributed electric propulsion). На аппарате установлено 16 импеллеров (импеллер — это винтовой электромотор, заключенный в кольцо или трубу), по четыре на каждом крыле, и в каждом импеллере по два электромотора. Благодаря такому большому числу двигателей обеспечивается безопасность: выход из строя даже шести моторов не ведет к потере аппарата.
Источник энергии — аккумуляторные батареи. Конечно, гибрид с двигателем внутреннего сгорания позволил бы увеличить дальность и время полета, но тогда могут возникнуть вопросы по шумности и применимости в городских условиях. «У нас пропеллеры маленькие, и высокочастотный звук, который они производят, затухает гораздо быстрее, чем низкочастотный от винта вертолета. Прототип получился очень тихий»,— подчеркивает операционный директор «Аэроксо».
А сколько может стоить такой персональный беспилотник? «Это вопрос серийного производства,— отвечает Спинко.
— Первые экземпляры будут под $200 тыс. С выходом на серию — от 50 и больше экземпляров в год — цена снизится вдвое, а выпуск 250–300 бортов в год позволит по стоимости уравнять авиабайк с мотоциклом »
К технологиям должно подтянуться законодательство. Европейское аэрокосмическое агентство уже выпустило «дорожную карту» и первые основополагающие документы, которые вводят правила сертификации таких аппаратов, в том числе персональных летательных аппаратов вертикального взлета и посадки. Путь сертификации в Европе долгий и сложный, но пока единственный. В России работа ведется очень медленно, хотя в компании верят: со временем законодательная база догонит стремительно летящие вперед технологии.
Когда же можно будет реально полетать на личном конвертоплане? Это вопрос полутора-двух лет, считает Владимир Спинко. А пока летающий мотоцикл примет участие в финале Go Fly Challenge, который состоится в 2020 году. На кону $1,6 млн — именно такой призовой фонд обещают организаторы.
Сколько стоит расшифровать геном человека и зачем это нужно

Об эксперте: Михаил Застрожин, кандидат медицинских наук, руководитель лаборатории генетики и геномики МНПЦ наркологии ДЗМ, доцент кафедры наркологии РМАНПО, CEO проекта PGX2 (биомедкластер «Сколково»).
По данным американского Управления по санитарному надзору (FDA), только в США ежегодно регистрируются около 2 млн серьезных нежелательных побочных реакций на лекарства. 100—240 тыс. из них — со смертельным исходом. На возникновение этих реакций влияют не только особенности конкретного лекарства или клинико-анамнестические характеристики пациента (тяжесть течения основного заболевания, наличие сопутствующих заболеваний, возраст, пол, вредные привычки), но и его генетические особенности, с которыми обычные лечащие врачи не знакомы. Для этого пациента направляют на фармакогенетическое исследование.
Его результаты помогает анализировать и интерпретировать биоинформационный облачный сервис PGX2.
Что это за сервис и для чего он нужен
Просто: сервис помогает оценить скорость метаболизма конкретного пациента. На основе этих данных врач может подбирать подходящую дозировку или тип препарата, чтобы избежать негативных побочных эффектов.
Сложнее: то, как именно преобразуются лекарства и с какой скоростью они выводятся из организма человека (другими словами, метаболизируются), во многом зависит от его генов. У одних людей высокая скорость метаболизма лекарств, а у других — низкая. За эту скорость отвечают белки, кодируемые определенными генами.
У людей с высокой скоростью метаболизма лекарство в нормальных дозах не будет работать. С помощью сервиса врач может назначить таким пациентам другой препарат или повышенную дозу лекарства.
У людей с низкой скоростью лекарство будет накапливается, и у пациента могут быть нежелательные реакции, о которых пишут в инструкциях к препаратам: головная боль, тошнота, седация и прочее.
Мы вычисляем пациентов, генетически предрасположенных к нежелательным реакциям по каждому конкретному лекарству, даем им рекомендации в соответствии с западными гайдлайнами (клиническими рекомендациями), таким образом повышая эффективность и безопасность терапии.

Почему это важно
Просто: когда врач общается с пациентом, часто выясняется, что лекарства, которые он пил раньше, не помогали, или их прием сопровождался головной болью, расстройствами ЖКТ и другими нежелательными побочными реакциями. Врач назначает новый препарат. Может случиться, что он поможет. Но проходит время, пациент мучается, могут развиться какие-то осложнения. Это потеря времени и качества жизни пациента.
Сложнее: персонализированная медицина позволяет сократить время поиска правильного лекарства в правильной дозе. Но для этого врач, заподозривший, что перед ним пациент с высоким риском низкой эффективности терапии, либо с высоким риском развития нежелательных реакций, должен отправить его на фармакогенетическое тестирование. Это исследование, по результатам которого можно оценить влияние особенностей конкретных генов на метаболизм, на эффективность и безопасность лекарств. Полученные данные загружают в специальный калькулятор. Это своего рода система поддержки принятия решения для конкретных лекарств. В этом калькуляторе используются все клинико-демографические данные — возраст, пол и т.д. — и генетические данные. Исходя из этого программа рекомендует лекарство и дозу.
Например: есть лекарства с узким терапевтическим интервалом: скажем, антикоагулянты и антиагреганты (они препятствуют образованию тромбов). Это значит, что оптимальной концентрации этих препаратов в крови, когда они могут помочь и не навредить, добиться сложно. Выход выше за это «окошко» чреват нежелательными реакциями вплоть до тяжелых кровотечений, а ниже — формированием тромбов и осложнений, связанных с ними.
Скажем, человеку провели кардиохирургическую операцию: поставили механический протез клапана сердца. Таким пациентам до конца жизни надо пить разжижающие кровь препараты, чтобы на новом клапане не образовался тромб. И всем им обязательно надо проводить фармакогенетическое тестирование перед назначением лекарства, иначе возможны осложнения и опасные кровотечения.
На Западе на сегодняшний день антикоагулянты и антиагреганты часто назначают на основе фармакогенетического тестирования.
В России фармакогенетическое тестирование применяется реже. Если в клинике нет своей генетической лаборатории, то врач может направить человека в какую-нибудь сетевую лабораторию и попросить его пройти тестированиет там.
Но проблема в том, что там биоинформатический сервис создает условный биоинформатик, который читает статьи, собранные по разным областям медицины, а не клиницист. Для какого-нибудь лекарства будет сказано, что с 60—70% вероятностью разовьются нежелательные реакции. Почему? На чем основано? Непонятно. У вас будет отчет по определенному количеству лекарств, с которым вы можете прийти к врачу, и он спросит: «Что это? Что я с этим должен делать?»
А как правильно?
Во всем мире сейчас применяют модель доказательной медицины. Проводятся исследования, разрабатываются гайды. Практикующие врачи используют рекомендации из них для лечения пациентов. Это не какие-то субъективные риски, которые произведены биоинформатическим сервисом, а конкретные рекомендации. Для каждого лекарства в гайдах прописано, каким образом корректировать дозу медленным метаболизаторам, какие — быстрым. По идее врач мог бы все это читать и держать это в голове. Но на самом деле это очень сложно, да и невозможно, как показывает практика.
Сервис PGX2 основан на доказательных алгоритмах. Его делает большая команда из научных работников, которые живут этими гайдами. Кто-то специализируется на кардиологии, кто-то — на психиатрии, аллергологии и так далее. Во всех областях есть специалист, который постоянно работает с этими темами и следит за актуальностью информации в сервисе.

Как работает сервис:
1. Пациент сам приходит в лабораторию по настоянию врача, или приносят его биоматериалы (волосы, слюну). Специалисты расшифровывают генетический код и вносят информацию об особенностях тех генов, которые кодируют белки, в сервис.
2. В основе сервиса лежит алгоритм. Он учитывает всю генетическую информацию о пациенте, занесенную специалистом — это перечень наиболее часто встречающихся генов, которые могут оказывать влияние на индивидуальный лекарственный ответ. Затем сервис «подтягивает» информацию из гайдов, анализирует все это и выдает итоговый отчет.
3. Этот отчет уже может прочитать врач: алгоритм сам расписывает лекарства по группам, рассказывает, какой препарат и в какой дозе надо назначать, а какой — нет, и почему.
Мы подходим индивидуально к каждому лекарству, основываясь на доказательности, апдейтах международных гайдов, и вся эта информация перерабатывается алгоритмами сервиса. В будущем также мы планируем оценивать межлекарственные взаимодействия. И мы хотим предоставлять доступ к нашему сервису сетевым лабораториям и лабораториям при крупных клиниках.
Проблема в том, что сейчас нейросети еще не в состоянии вникнуть во все нюансы. Поэтому даже если взять самую крутую нейросетку, она, к сожалению, не сможет так проанализировать данные, как это сделает человек.
Сейчас доверять это нейросети опасно: если бы группа людей вбивала эти гайды (как сегодня делаем мы), и на основании них мне бы назначили терапию, я бы согласился. Если бы мне сказали, что это сделала нейросеть, я бы сам захотел перепроверить, что она написала.
На практике: врачи очень плохо понимают генетическое тестирование.
Даже если у врача на руках будут «сырые» данные тестирования, он ничего не сможет с этим сделать. Поэтому нужно более активно просвещать врачей о преимуществах персонализированной медицины и фармакогенетики как основного инструмента персонализации. Для этого, например, на базе Российской медицинской академии непрерывного профессионального образования Минздрава России и Московского научно-практического центра наркологии Департамента здравоохранения Москвы проводятся специализированные образовательные циклы повышения квалификации.

На практике: сейчас в лабораториях дорогие и неполные данные.
Если врач в курсе важности фармакогенетического тестирования, он может направить пациента в лабораторию. Но сейчас человек получит информацию только про одно лекарство за большие деньги — от 2 до 10 тыс. руб. Пока что частные лаборатории предоставляют только такие услуги. Доступ к нашему сервису позволит лабораториям формировать рекомендации по дозированию не для одного лекарства, а для целого спектра лекарств, не меняя стоимость услуги.

На практике: некоторые врачи уже знают о фармакогенетическом тестировании и его преимуществах перед эмпирическим подбором терапии.
Это от многих факторов зависит: есть ли, например, клинический фармаколог в больнице, частный или государственный это медицинский центр. Клинические фармакологии знают, что гены могут оказывать влияние на эффективность и безопасность лекарств, и они хотят получать нормальные рекомендации. Мы проводим определенную работу в этом направлении: например, читаем лекции в РМАНПО Минздрава России и других учреждениях.
На практике: на законодательном уровне это никак не регулируется.
Но спрос на генетические услуги растет, и Владимир Путин заявил, что к 2025 году будут созданы генетические паспорта граждан. Так что постепенно в этой области сформируется законодательство.
Перспектива: для создания генетических паспортов надо полностью расшифровать геномы всех граждан — на каждого человека это 3 млрд нуклеотидов.
Вся эта информация записывается в специальный файл, и с ним в дальнейшем можно что-то делать. Кто будет расшифровывать и за какие средства, я не знаю. В российских лабораториях полногеномное секвенирование стоит около 90 тыс. руб. Таким образом, с помощью результатов секвенирования и достижений фармакогенетики, можно будет подобрать максимально эффективную и безопасную терапию для каждого пациента.
Перспектива: развитие телемедицины.
С телемедициной сейчас такая же штука происходит, что и с фармакогенетическим тестированием, — до конца законодательством это не отрегулировано. И хотя закон о телемедицине был принят в 2018 году, в России нет инфраструктуры для того, чтобы с этим работать — есть только несколько сервисов.

Например, DocDoc, который вошел в экосистему Сбербанка пару лет назад: созваниваешься с врачом, он тебя консультирует и дает официальное заключение с рецептом. С ним можно прийти в поликлинику и получить лекарство.
Но есть много технических проблем: например, отсутствие доступа к широкополосному интернету. В таких условиях сложно говорить о развитии телемедицины: тот же проект Единой государственной информационной системы здравоохранения — это просто запись к врачу по удаленке.
Подписывайтесь и читайте нас в Яндекс.Дзене — технологии, инновации, эко-номика, образование и шеринг в одном канале.
Сайт о нанотехнологиях #1 в России
Прибор для оперативного анализа генома человека
Сибирские институты объединились для изготовления прибора, позволяющего быстро просчитать ДНК человека
Год назад в Сибири началась работа по изготовлению отечественного секвинатора ДНК для проведения быстрого анализа генома человека
 .
.
Как сообщил порталу Сибкрай.ru директор Института химической биологии и фундаментальной медицины СО РАН, заместитель председателя СО РАН, академик Валентин Власов, год назад был поставлена задача сделать в Сибири российский секвинатор, который быстро позволяет просчитать ДНК. Сибирское отделение начало финансирование. Работа ведется, уже многое сделано, хотя прошел только год.
- Прибор, аналогов которому нет в мире, позволит быстро просчитать геном человека с целью выявления изменений в генах, вызывающих ряд опасных заболеваний, в том числе онкологических, сердечно-сосудистых, неврологических, связанных с обменом веществ и других. Цель разработчиков – сделать эту технологию доступной для общественного здравоохранения.
- «Сейчас работа ведется альянсом нескольких институтов. В проекте используется ряд тонких физических технологий, в которых мы лидируем. К примеру, Институт физики полупроводников лидирует в области создания ряда материалов, Институт автоматики может разработать хорошие системы слежения. Есть эксперт по ферментам. У нас имеются неплохие наработки в области нанотехнологий», – пояснил академик.
Сравнивая финансирование подобных проектов в России и за рубежом, он подчеркнул, что «вложения в науку у нас несопоставимы». Между тем эта технология должна стать массовой.
Власов также сообщил, что в США учредили внушительный денежный приз тому, кто разработает прибор, способный дешево и быстро просчитать геном человека, чтобы эта услуга стоила не более тысячи долларов.
Институт химической биологии и фундаментальной медицины СО РАН
Межинститутский центр секвенирования ДНК
- nikst’s блог
- Войдите на сайт для отправки комментариев
![]()
- Может быть, и не совсем по нашей теме. Но всё равно, это большое (и уникальное) достижение. Но, кроме того, в этом институте – Институте химической биологии и фундаментальной медицины СО РАН – ведутся работы и по нашей тематике. “У нас имеются неплохие наработки в области нанотехнологий», – пояснил академик. Так что и здесь имеются наши коллеги, которые двигают нанонауку и нанотехнологии вперёд…
- Войдите на сайт для отправки комментариев
![]()
Уже в обозримом будущем биологи совершат революцию в медицине – академик Власов
«Сейчас биология вступила в такой этап, когда стало возможным не только изучать, как и что устроено, но и принести ощутимую пользу медицине», – заявил директор Института химической биологии и фундаментальной медицины СО РАН, заместитель председателя СО РАН, академик Валентин Власов.
На пресс-конференции в ходе пресс-тура, посвященного инновационной научно-практической программе «Генетическая карта здоровья», он, в частности, отметил, что нынешнее время называют веком биологии и медицины.
«Это действительно так. Сегодня биология и фундаментальная медицина – быстро развивающиеся области знания. Время сбора предварительной информации, коллекционирования бабочек и систематизации прошло. За последние десятилетия произошло ощутимое развитие молекулярной биологии. В конце прошлого века был расшифрован геном человека, стало ясно, как устроена ДНК. Появились биотехнологии – это производство белков, ферментов, полезных материалов», – сказал академик.
И теперь накопленные биологией знания о человеке и животных стали находить применение в медицине. «Появились различные инструментальные методы анализа, генетические методы, которые позволяют точно характеризовать состояние организма. Более того, сейчас разрабатывают биотехнологические методы, с помощью которых можно воздействовать на организм», – пояснил Власов.
- Рассуждая о том, что такое болезнь, он отметил, что при инфекционной болезни в организм попадает вирус, микроб, который размножается и начинает приносить человеку вред. Задача врача – уничтожить этот вирус или микроб либо помочь организму самостоятельно с ними бороться. Некоторые виды рака также могут быть спровоцированы вирусами.
«Попадание вирусов в организм может вызывать рак, это точно установлено. И даже пробуется уже вакцинация», – заметил ученый. Так, например, при выявлении вируса папилломы человека 16–18 типов опасности проводится вакцинация в целях предупреждения определенного вида рака.
Однако, помимо возможности «заразиться» существует еще предрасположенность к раку. Это подтверждено опытами на животных – выявлены высокораковые линии мышей, где все животные и их потомки заболевают одним видом рака, они генетически к этому подготовлены.
«У людей тоже есть такая предрасположенность. Сегодня одна из главных задач медицинской биологии (или биологической медицины) – установить соответствие между определенными генами, которые имеются у человека или у членов его семьи, и склонностью к развитию заболевания. И эта работа уже ведется: берутся тысячи пациентов, у них изучается структура ДНК, и затем ученые пытаются установить, какая последовательность соответствует определенному заболеванию», – пояснил Власов.
По его данным, это одно из центральных направлений исследований, которое поддерживается и в Европейском союзе, и в США. Между тем методы генной диагностики, позволяющие читать гены, уже применяются в поликлиниках для определения инфекционных агентов.
«Геномы опасных вирусов давно расшифрованы. Методы диагностики основаны на том, что сдается кровь или какой-либо мазок, и в них определяется наличие вирусов. То есть инфекционный агент определяется по наличию генетического материала. И не просто вирус, а его конкретный вид. К примеру, у вирусов гепатита С есть несколько подтипов, которые слегка отличаются друг от друга. То же самое и с вирусом СПИДа. Чтобы правильно лечить пациента, нужно знать, какой подтип этот вирус имеет», – сказал академик.
Далее он акцентировал внимание на выявлении предрасположенности человека к какому-либо заболеванию. К примеру, наличие дефекта в одном гене (когда он не работает, не синтезируется белок) может привести к тому, что у новорожденного ребенка, если ему не изменить систему питания, рано или поздно произойдет поражение головного мозга. Предрасположенность к этому заболеванию можно выявить при проведении анализа генотипов обоих родителей. Появились такие приборы, которые позволяют это сделать. Правда, сегодня это весьма дорогая вещь. Геном человека расшифровывали более десяти лет, многие страны вложили в эти исследования миллиарды долларов. Сейчас, например, американские фирмы предлагают полное секвинирование генома любого пациента за 200 тыс. долларов.
- В Сибири также ведется работа по изготовлению отечественного секвинатора ДНК для проведения быстрого анализа генома человека. Власов отметил, что год назад перед сибирскими учеными была поставлена задача сделать отечественный секвинатор. Прибор, аналогов которому нет в мире, позволит быстро просчитать геном человека с целью выявления в генах изменений, которые вызывают ряд опасных заболеваний – онкологических, сердечно-сосудистых, неврологических, связанных с обменом веществ и других. Разработчики хотят сделать эту технологию доступной для общественного здравоохранения.
«Сейчас работа ведется альянсом нескольких институтов. В проекте используется ряд тонких физических технологий, в которых мы являемся лидерами. К примеру, Институт полупроводников лидирует в области создания ряда материалов. Институт автоматики может разработать хорошие системы слежения. Есть эксперт по ферментам. Имеются неплохие наработки в области нанотехнологий», – пояснил академик.
Сравнивая финансирование подобных проектов в нашей стране и за рубежом, он подчеркнул, что «вложения несопоставимы». Например, в США учредили внушительный денежный приз тому, кто разработает прибор, способный дешево и быстро просчитать геном человека, чтобы такая услуга стоила не более тысячи долларов. Ведь эта технология должна стать массовой.
- Новосибирские ученые считают, что генетическое тестирование – выявление предрасположенности к тому или иному опасному заболеванию – поможет людям обезопасить себя от развития разных видов патологии. В настоящее время уже доказана взаимосвязь между набором генетических маркеров и предрасположенностью к определенным заболеваниям, в том числе к онкологическим, гипертонии, сахарному диабету и другим. Генетическое исследование можно проводить в любом возрасте.
Ученые не исключают, что в ближайшем будущем станет возможным проведение так называемой полной генетической паспортизации, которая позволит заранее выявить людей, предрасположенных к опасному заболеванию, и дать им рекомендации по профилактике.
Как это работает? Человек сдает кровь на анализ, после которого врачи могут с большой долей уверенности делать вывод о том, какие заболевания у него могут развиться в будущем. Например, некоторые виды опухоли или слишком маленькие пока очаги невозможно обнаружить традиционными методами диагностики. Но генетический анализ способен их выявлять или обнаруживать возможность их появления.
«Наша мечта – провести полную генетическую паспортизацию населения области. Я не думаю, что здесь нужны фантастические средства. Если создать правовую базу, найти ресурсы, то от этого была бы огромная польза. Вы знаете, общая проблема нашего общества – старение. Накапливается много больных людей. Если провести генетическую паспортизацию, то эту проблему можно было бы решать – выявлять будущие заболевания заранее и проводить профилактику, чтобы человек и в преклонном возрасте оставался здоровым», – заявил академик.
Он уверен, что лет через пять лет можно будет, по желанию родителей, делать такие генетические исследования и для детей.
- Далее Власов рассказал о новых разработках в онкологии и генной терапии, которые позволяют обнаружить опухоль микроскопических размеров. Проводятся также опыты по исправлению поврежденных генов. «Чаще всего опухоль обнаруживают при проведении ультразвукового исследования, когда она достигает внушительных размеров. При помощи внеклеточных кислот из крови можно обнаружить опухоль микроскопических размеров. Даже на начале образования она уже посылает в кровь свои материалы, по которым заболевание можно выявить заранее», – пояснил академик. По его словам, этот метод – «первый этап применения генетического анализа».
Как ученые расшифровывают геномы и зачем это нужно? Отвечаем в 9 карточках
В последние годы ученые постоянно объявляют о расшифровке геномов тех или иных видов. ITMO.NEWS и ученый Международного научного центра SCAMT Алексей Комиссаров в карточках объясняют: что такое ДНК, как с ее помощью изучают историю животных и в чем отличие ДНК-теста от геномного исследования.

Иллюстрации: Дмитрий Лисовский, ITMO.NEWS
По пунктам:
- Начнем с простого: что такое ДНК?
- Говорят, ДНК можно получить из волоса, слюны, крови. А каким образом?
- А есть еще геном. Это одно и то же?
- Я все время слышу: расшифровали геном того, расшифровали геном сего. А кто его зашифровывает?
- Говорят, по геному можно проследить генетическую историю. Это что-то типа ДНК-теста?
- А как ученые берут кровь или шерсть у современного льва, а получают данные о его предках?
- Мы говорим, что взяли кость тигра раннего палеолита и по ней определили какие-то вещи про целую популяцию. Но как мы отделяем эту информацию от той, что была присуща именно вот этому самому тигру?
- А как мы проверяем наши выводы? Ведь не всегда мы можем выкопать пещерного предка современных животных и удостовериться, что все сходится.
- Зачем нам все это?
Начнем с простого: что такое ДНК?

Каждый более или менее знает, что есть белки, жиры и углеводы. Но еще у нас в каждой клетке есть ДНК, дезоксирибонуклеиновые кислоты, которые отвечают за хранение информации. Для геномного биоинформатика ДНК ― это прежде всего один из главных языков биологии, который состоит всего лишь из четырех букв: A, T, G и C. Эти буквы являются сокращениями имен четырех азотистых оснований, из которых состоит ДНК: аденин (А), цитозин (C), гуанин (G) и тимин (Т). ДНК можно сравнить с компьютерной программой, очень сложной, запутанной, со множеством ошибок и костылей, но, тем не менее, она работает.
Говорят, ДНК можно получить из волоса, слюны, крови. А каким образом?

ДНК содержится почти во всех клетках организма, исключение — эритроциты, которые в зрелом состоянии теряют ядро, чтобы было легче переносить кислород. Поэтому биологический материал для выделения ДНК может быть разнообразен. Процесс выделения ДНК состоит из четырех этапов: разрушение мембраны клеток для высвобождения ДНК; очистка от связанных с ДНК белков; очистка от разного рода примесей; растворение ДНК для хранения. ДНК можно выделить и в домашних условиях, но тогда ДНК будет не очень чистой и ее будет сложно использовать для каких-либо научных исследований. От качества этих процедур будет зависеть и полученная из нее информация. Поэтому необходима лабораторная точность работы специалистов, молекулярных биологов. Проще всего ДНК выделять из крови, потому что это легкий для получения биоматериал. Хотя в эритроцитах ДНК нет, в крови плавает огромное количество других клеток — белых кровяных телец, так что и ДНК из них получается много. Из слюны или кусочков эпителия во рту ― уже меньше, из волос ― еще меньше. Например, чтобы прочитать весь геном достаточно точно, необходима кровь, а не слюна. А для того, чтобы сделать какой-нибудь ДНК-тест, где точность не очень важна ― достаточно и слюны.
А есть еще геном. Это одно и то же?

ДНК — это название молекулы, которая хранит наследственную информацию. Геном ― это совокупность всей ДНК организма со всеми записанными в ней особенностями конкретного вида или даже индивида. Поэтому можно говорить о геноме человека вообще, а можно — о геноме конкретных Васи или Кати. На физическом уровне геном разделен на хромосомы, в случае человека — 23 пары хромосом, 23 от мамы, и 23 от папы, всего 46. Когда организм начинает расти после оплодотворения, в каждой клетке копируется этот набор, но иногда это происходит с небольшими ошибками. Это называется соматическими мутациями. Иногда эти ошибки могут быть весьма критическими и приводить к разным заболеваниям.
Я все время слышу: расшифровали геном того, расшифровали геном сего. А кто его зашифровывает?

Его никто не зашифровывал, но это слово хорошо передает ощущения от работы с геномными данными. Если продолжать аналогию с геномом как с очень сложной программой, можно сказать, что она не только очень сложная, но и очень плохо написана. И кроме собственно четырех букв A, C, G и Т, он содержит много дополнительных уровней кодирования информации, которые не обязательно будут наследоваться и могут меняться в процессе жизни организма. Это часто называют эпигеномом, который изучает эпигенетика. Вся эта неимоверная сложность и создает ощущение расшифровки. Помимо этого, злую шутку здесь сыграл не очень корректный перевод с английского, где использовали слово decoding и encoding, декодировали и закодировали. Код — это просто система условных обозначений, не предполагающая никакого секрета, никакой защиты от взлома. Любой человеческий язык — это код, система дорожных знаков — это код. Шифр — это код, намеренно защищенный от взлома. Но, конечно, в английских терминах меньше романтики, чем в слове расшифровали.
Говорят, по геному можно проследить генетическую историю. Это что-то типа ДНК-теста?

Под ДНК-тестом часто имеют в виду анализ только некоторых небольших участков генома, вариации в которых имеют какой-то известный эффект. В геномных исследованиях ученые работают с гораздо большим количеством ДНК, в идеале со всей доступной информацией. Это называется полногеномными исследованиями. Но даже генетических тестов, направленных на выяснения значения только некоторых фрагментов генома, часто достаточно для того, чтобы проследить генетическую историю или оценить степень родства между двумя людьми. Это возможно, во-первых, благодаря тому, что у нас в геноме есть фрагменты, которые очень вариабельны и отличаются у разных людей, и, во-вторых, благодаря математике.
А как ученые берут кровь или шерсть у современного льва, а получают данные о его предках?

Есть очень сложные математические алгоритмы, которые позволяют по генетическим данным найти наиболее вероятный сценария развития событий: когда происходили мутации отдельных фрагментов, которые привели к образованию того генома, который мы видим сейчас. Своего рода, математическая машина времени. Ученые ИТМО недавно опубликовали программу, направленную как раз на решение проблемы — как наиболее точно заглянуть в прошлое генома. Одним из самых захватывающих расширений этого подхода является добавление еще и географических точек. Тогда мы можем не только смоделировать, как происходили изменения в геноме, ни и посмотреть, как отдельные популяции с этими геномными вариациями перемещались из одной точки в другую.
Мы говорим, что взяли кость тигра раннего палеолита и по ней определили какие-то вещи про целую популяцию. Но как мы отделяем эту информацию от той, что была присуща именно вот этому самому тигру?

Мы стараемся получить модель, которая наиболее правдоподобно описывает сценарий развития событий в прошлом. Чтобы сделать модель более точной, одного образца часто недостаточно, и чем больше образцов у нас есть, тем более точной становится наша модель. У каждого из нас очень много редких генетических вариантов, бывают и варианты, которые присущи только нам. И если у нас есть уже несколько образов, то такие индивидуальные варианты ученые отфильтровывают именно затем, чтобы они не мешали анализу. Так как единицей эволюции является популяция, а не отдельный индивид.
А как мы проверяем наши выводы? Ведь не всегда мы можем выкопать пещерного предка современных животных и удостовериться, что все сходится.

Хорошие модели обладают предсказательной способностью. Проверить проще всего новыми данными, которые не должны противоречить модели, но случается, что они противоречат, и тогда модель приходится пересчитывать. Сейчас мы наблюдаем очень красивую иллюстрацию мутаций, эволюции и вот этого всего на примере геномов коронавируса SARS-CoV-2. Настолько подробных данных об эволюции отдельного вида в реальном времени у человечества еще никогда не было. И появляется все больше данных и для остальных геномов. Со временем модели будут все лучше и лучше, а чем больше данных ― тем лучше модели.
Зачем нам все это?

Кроме того, что это захватывающе любопытно, это имеет множество практических применений во всех сферах деятельности человека. Если продолжать рассуждать об исследовании истории предков, то есть математический аппарат для поиска так называемых событий бутылочного горлышка, когда размер популяции по каким-то причинам резко сократился. Поиск таких событий, своего рода, геномная археология, может дать нам подсказки, как таких событий избежать. Это важно особенно сейчас, когда многие виды животных бесследно исчезают с лица земли.
Суперкомпьютеры, секвенирование генома и перспективы победы над коронавирусом
Джастин Эр, менеджер по глобальным коммуникациям
Одна капля жидкости, которую выдыхает человек, может содержать миллиарды частиц коронавируса. В каждой из них с определенными вариациями будет около 30 000 нуклеотидов ДНК. Таков показатель плотности в вирусном геноме, отвечающем за каждую особенность и специфическую черту вируса — от его вирулентности до механизмов передачи. Исследователи из Китая и других стран мира уже определили ряд геномных последовательностей нового коронавируса SARS-CoV-2, предоставив ученым и медикам базовые знания для начала борьбы с инфекцией.
Минутка заботы от НЛО
В мире официально объявлена пандемия COVID-19 — потенциально тяжёлой острой респираторной инфекции, вызываемой коронавирусом SARS-CoV-2 (2019-nCoV). На Хабре много информации по этой теме — всегда помните о том, что она может быть как достоверной/полезной, так и наоборот.
Мы призываем вас критично относиться к любой публикуемой информации
- Cайт Министерства здравоохранения РФ
- Cайт Роспотребнадзора
- Сайт ВОЗ (англ)
- Сайт ВОЗ
- Сайты и официальные группы оперативных штабов в регионах
Если вы проживаете не в России, обратитесь к аналогичным сайтам вашей страны.
Мойте руки, берегите близких, по возможности оставайтесь дома и работайте удалённо.
Но составление карт геномов коронавирусов — это лишь начало работы. Экспоненциально более сложным и не менее важным для понимания характера пандемии является определение последовательности геномов инфицированных людей. Здесь возникает множество вопросов: почему один вирус более заразен, чем другие? Какие механизмы приводят к развитию пневмонии у одних больных и лишь легкому кашлю у других? Как отдельные пациенты будут реагировать на различные виды лечения или введение вакцины?
Ответы нужно искать в области взаимодействия генома человека и штаммов вирусов. Понимание этого процесса на уровне ДНК открывает путь к диагностике заболеваний, созданию противовирусных вакцин и иммунотерапии.
Исследователи из компании BGI Genomics, которые разработали первые диагностические тест-наборы для выявления заболевания COVID-19, участвуют в кропотливой и масштабной работе по расшифровке генома нового коронавируса. Чтобы разработать эффективную вакцину, ученым нужны массивные наборы данных для выявления генетических различий и создания потенциальной защиты. При такой масштабной работе генерируются терабайты и петабайты данных, с обработкой и анализом которых могут справиться лишь системы высокопроизводительных вычислений (HPC).
Скорость секвенирования генома растет вместе с ростом вычислительной мощности. Процесс, который изначально занимал более десяти лет и стоил миллиарды, теперь можно выполнить всего за несколько часов на кластерах суперкомпьютеров, работающих на оптимизированной аппаратной архитектуре. Исследователи подчеркивают, что путь к созданию вакцины, вероятно, будет долгим, однако такой беспрецедентный набор инструментов поможет сократить сроки.

«Чтобы проанализировать и выявить осложнения, возникающие из-за вирусной инфекции, BGI Genomics секвенировала сотни клинических образцов, — отмечает Сянцянь Цзинь, ИТ-директор BGI Genomics. — Доступ к новейшим технологиям высокопроизводительных вычислений и геномной аналитики является важным фактором повышения эффективности анализа».
Исследователь BGI Genomics работает с секвенатором T7
Желая поддержать BGI и расширить возможности исследователей, ведущих борьбу с COVID-19, Intel и Lenovo объединили усилия. Они подарили ученым суперкомпьютерный кластер, а также предложили свою экспертизу в области программного и аппаратного обеспечения для максимально эффективного использования.
«Мы стараемся делать все возможное, чтобы поддержать ученых и медиков, которые находятся на передовой борьбы с новым коронавирусом», — объясняет ведущий специалист Lenovo по исследованиям и разработкам в области геномики Милиди Джиральдо.
«Мы дарим оборудование и предлагаем свои экспертные знания, но настоящий прорыв обеспечат те результаты, которых добьются исследователи BGI и другие представители биомедицинского сообщества».
Кластер HPC позволит изучить вирулентность, схемы передачи патогена и взаимодействия между хозяином и вирусом. В результате этой работы BGI надеется оптимизировать свои диагностические наборы COVID-19, получить множество знаний о коронавирусе, ускорить разработку эффективной вакцины или других защитных мер — например, иммунотерапии.
Расшифровка генома
Геном каждого человека на Земле можно представить как книгу с тысячей страниц. Но ее необычный текст будет содержать всего четыре буквы: AGCT. Они обозначают комбинацию нуклеотидов в ДНК и содержат инструкции для каждой черты, каждой особенности, которая делает вас тем, кто вы есть: определяет цвет волос, рост и даже подверженность такому заболеванию, как COVID-19. Большинство этих инструкций написаны для всех людей одинаково, однако самые важные вариации скрыты всего на нескольких страницах.

Чтобы понять, как проявляется у конкретного человека восприимчивость к инфекции, исследователи должны определить точные «страницы» (то есть гены) с соответствующими инструкциями. Это можно сделать только путем сравнения «страниц» у максимально возможного количества пациентов — с выявлением общих характеристик и последующим использованием данных, связывающих эти вариации с реагированием на инфекцию.
При секвенировании генома нужно учитывать, что 1 мл биологического образца обычно содержит миллионы различных вирионов, а каждый из них, в свою очередь, имеет геном примерно с 30 000 нуклеотидов ДНК.
Эта чрезвычайно сложная задача расшифровки и интерпретации генома и лежит в основе борьбы ученых с новым коронавирусом. Понимание взаимодействия между соответствующими человеческими генами и SARS-CoV-2 может выявить способы сдержать или полностью остановить инфицирование. Ученые также будут искать общие «страницы» в книге самого коронавируса — выявлять области генома, в которых патоген не может перенести мутации. Это своего рода ахиллесова пята, которая может открыть путь к созданию вакцины или поиску лечения.
Разработка вакцины
В фильмах об эпидемиях, как правило, есть момент, когда ученые охотятся за единственным невосприимчивым к болезни человеком. В этом есть определенный смысл: природный иммунитет может дать ключевое представление о путях разработки эффективной вакцины.
«Правда, в этих фильмах отсутствует реалистичный масштаб времени, — отмечает доктор Джиральдо. — Они не показывают продолжительную работу по расшифровке генома, порой охватывающую месяцы или даже годы, которые уходят на сравнение больших наборов данных в одном конкретном геноме и между разными пациентами. Кроме того, в сценарии игнорируется время, затрачиваемое на клинические испытания. Они нужны для того, чтобы проверить многочисленные варианты вакцины, пока не будет найден один — с наиболее высокой эффективностью и наименьшим побочным действием».
Коронавирус венчает кольцо похожих на корону шипов, которые и определили его название.
Рассмотрим две реакции пациента на вирус: у одного развивается опасная для жизни пневмония, а у другого — лишь легкий кашель. Что объясняет подобные различия? Сниженный иммунитет? Генетическая предрасположенность? Последствия другой болезни, перенесенной в прошлом? Возраст? Пол? Питание? Доминирование определенного штамма вируса? Ответить на эти вопросы, сравнивая двух пациентов, — уже непросто. А применительно к тысячам человек сложность задачи многократно возрастает.
Однако только огромный массив данных поможет начать процесс изучения бесчисленных вариаций генов и факторов влияния окружающей среды. Чем больше у ученых клинических и геномных данных, тем лучше и точнее они смогут определить общие черты у разных пациентов.
Геномика в масштабе всего народонаселения — это миллиарды единиц информации. Для изучения нового коронавируса ученые надеются сравнить ДНК десятков тысяч диагностированных пациентов. Это сложная задача, требующая серьезной вычислительной мощности и большой емкости, доступных только в среде HPC.
Оптимизация HPC
Помните «книгу» генома? Ту, на первое прочтение которой требовалось целое десятилетие? Теперь исследователи анализируют геном примерно за 150 часов. Это, конечно, фантастический скачок, но все же такой скорости недостаточно для борьбы с пандемией COVID-19. Даже выделение и секвенирование битов, которые кодируют структуру белка и механизм размножения вируса (а это несколько «страниц», называемых экзомами), обычно занимает не менее 4 часов.
Теперь исследователи BGI могут получить доступ к кластерам HPC, оптимизированным для сбора и анализа целых сотен геномов и тысяч экзом.
«Благодаря этой донации мы надеемся расширить те ресурсы, которые исследователи BGI уже имеют в своем распоряжении, чтобы биомедики быстрее решили поставленную задачу, — подчеркнул д-р Хиральдо. — Трудно придумать лучший пример использования технологий для решения важнейших задач человечества: ученые, врачи и инженеры объединили свои усилия, чтобы сделать все возможное для борьбы с пандемией коронавируса».
«Этот процесс полностью ориентирован на реальные потребности ученых, — подчеркивает д-р Джиральдо. — Исследователи должны сфокусироваться непосредственно на науке, а не заниматься оборудованием. Поэтому мы перебрали все доступные нам аппаратные компоненты, «строительные блоки», составляющие оптимальную конфигурацию для ускорения выполнения задачи. В наших тестах использовались те же программы, что и в исследовательских лабораториях, поэтому решение было сразу готовым к применению».
В результате весь человеческий геном секвенируется за пять с половиной часов, а экзом — всего за четыре минуты. Ускорение достигает 40-кратных значений. При поддержке специализированного суперкомпьютерного кластера исследователи BGI вскоре приступят к активной работе, используя GOAST для изучения нового коронавируса и создания вакцины.
В краткосрочной перспективе прогнозирование вирулентности на основе доминирующих штаммов может помочь больницам эффективнее распределять пациентов — они будут знать, кто подвергается большему риску и какие методы лечения будут наиболее действенными. В долгосрочной перспективе, помимо создания вакцины, знание геномной истории и места происхождения вируса поможет предотвратить будущие вспышки. В общем, это невероятно емкая и сложная головоломка, которую нужно решить.
Современное оборудование и технологии ускорят распознавание людей, инфицированных COVID-19, а изучение характеристик генома вируса будет способствовать точной диагностике, успешному лечению и профилактике эпидемий.
Расшифровать ДНК: как компания Illumina ускоряет генетическую революцию

Малышка Шелби появилась на свет в 2000 году и при рождении выглядела бессильной, как тряпичная кукла. Девочка постепенно училась ходить и разговаривать, но делала это медленно и не успевала за стандартными этапами развития. К четырем годам она была прикована к инвалидному креслу, а в пятом классе начала пользоваться компьютеризированным голосом для общения с людьми. Ее мать, Рене Валинт, в отчаянии отвезла Шелби в клинику Майо в Рочестере, штат Миннесотта, чтобы лучшие врачи страны США обследовали ее в очередной раз.
«Они все разводили руками и говорили: «Мы понятия не имеем, что с ней происходит», — вспоминает Рене. — В тот момент она вообще не могла двигаться. Я ее купала, кормила. Она даже не могла глотать. Мне приходилось сгущать жидкость, чтобы она могла глотать и не давиться. Это было похоже на кошмарный сон. Это был конец. Дальше идти было некуда».
Но решение пришло тогда, когда его меньше всего ждали.
Врачи в Трансатлантическом институте исследований генома в Фениксе воспользовались новой технологией секвенирования (определения последовательности) ДНК, чтобы изучить гены Шелби. На основе данных исследования они предположили, что у нее может быть положительная реакция на препараты, повышающие уровень допамина — наподобие тех, которые прописывают пациентам с болезнью Паркинсона. Через три месяца Шелби смогла встать. На следующий день она сама пошла в школу и с тех пор обходится без инвалидного кресла. Сейчас она любит танцевать.
Сегодня наблюдается бурный рост рынка приборов для секвенирования ДНК. Крупнейшие онкологические центры используют их, чтобы правильно назначить препараты пациентам, у которых других вариантов уже не осталось. Секвенаторы ДНК теперь позволяют диагностировать синдром Дауна и другие генные нарушения еще на стадии эмбриона — достаточно пробирки с кровью матери. Они приходят на смену устаревшим и дорогим способам анализа ДНК.
За последние 13 лет стоимость секвенирования сократилась просто невероятно — со $100 млн за геном человека до всего лишь $1000.
Еще один удивительный факт: бенефициаром революции в сфере расшифровки ДНК является всего лишь одна компания — Illumina из Сан-Диего.
И основная заслуга в этом принадлежит одному предпринимателю — ее генеральному директору 61-летнему Джею Флэтли. Именно под его руководством Illumina восемь лет назад заняла лидирующие позиции на рынке секвенаторов ДНК, и с тех пор ее доля составляет около 80%. При этом компанию постоянно осаждают конкуренты с широкими карманами.
С 2008 года годовые продажи и прибыль Illumina выросли синхронно на 147% и сегодня составляют $1,42 млрд и $125 млн соответственно. За этот же период акции компании выросли на 617%, а ее рыночная капитализация достигла $23 млрд.
«У нас есть свои методы расчета потенциала рынка, — говорит Флэтли. — Если мы не сбавим набранный темп и останемся лидерами в области секвенирования, то в ближайшие 5-10 лет мы сможем вывести компанию на уровень фантастической прибыльности».
По прогнозу Macquarie Securities, рынок дешифраторов ДНК может вырасти в десять раз, достигнув $23 млрд. Illumina сейчас активно расширяет штат и производство и планирует выйти на уровень продаж в $5-10 млрд в год.
«Компания с долей на рынке от 80% до 90%, которая так стремительно развивает технологии, что за ней не могут угнаться конкуренты, — большая редкость, — говорит Кэти Вуд, директор по инвестициям из ARK Investment Management. — Этот сектор сейчас на этапе формирования. Я знаю, что оценка этого рынка в $20 млрд звучит невероятно, но это правда».
История успеха Illumina — не про гениальную идею или про счастливую догадку, которая больше никому не пришла в голову. Скорее, это история о педантичной, близкой к идеалу реализации, которая стала возможна исключительно благодаря заданным Флэтли стандартам. «Я не ученый, — говорит генеральный директор, получивший образование инженера-технолога в Стэнфорде. — Моя роль в Illumina заключается не в том, чтобы помочь совершить научный прорыв. Я забочусь о том, чтобы мы делали отличный продукт и максимально оперативно поставляли его на рынок».
Флэтли — приятный в общении, но скучный человек. Он сидит в офисной ячейке (потому что недолюбливает отдельные кабинеты) в голубой рубашке с расстегнутым воротником. Он не склонен произносить монологи об изменении мира.
Даже его собственный геном, когда он в первый раз проанализировал его последовательность, оказался заурядным.
Самой интересной деталью оказался ген мутации под названием «семейный холодовой аутовоспалительный синдром». В его случае это проявилось всего в одном симптоме: в детстве у Флэтли на холоде возникало раздражение кожи. Но благодаря своей сосредоточенности на реализации он, вероятно, один из самых эффективных руководителей в медико-биологической отрасли. А может быть, и в любой отрасли.
Illumina была основана в 1998 году, когда еще не существовало ни самих секвенаторов, ни даже их прототипов. Основатели компании пригласили Флэтли на работу в 1999 году. Перед этим он успешно продал свой предыдущий проект — Molecular Dynamics — за $300 млн. В то время в Illumina даже еще и не думали зарабатывать на определении последовательностей ДНК. К слову, тогда разовая подобная процедура стоила $360 млн для одного человека. Компания планировала заниматься моментальными снимками генов.
К тому моменту на рынке уже был сильный игрок — компания Affymetrix, которая производила ДНК-микроматрицы — крошечные стеклянные пластинки со специфическими паттернами генов. Эта технология основывалась на том, что четырехбуквенный код ДНК — A, G, T, C — в двух противоположных нитях соединяется определенным образом: A с T, G с C. То есть если противоположная последовательность присутствует, скажем, в крови, то она присоединяется к генной матрице по примеру ленты-липучки. Но в Illumina придумали кое-что получше: поместить ДНК не на пластины, а на микроскопические шарики. Таким образом, они увеличили поверхность исследуемого материала, повысили соотношение сигнал/шум, благодаря чему планировали получать более точные результаты.
Флэтли сумел привлечь $100 млн, пока акции генных компаний были на взлете. Он сделал все возможное, чтобы спасти Illumina, когда их партнерская компания Applied Biosystems, тогда ключевой производитель ДНК-секвенаторов, пошла ко дну. Флэтли был внимателен к своим сотрудникам и лично подписывал поздравительные открытки с днем рождения каждому из них, пока в 2006 году штат Illumina не превысил 500 человек.
Кроме того, он был одержим идеей, что с ним должны работать только правильные люди. Однажды он даже уволил одного из основателей компании — директора по науке Энтони Чарника. Тот утверждал, что Флэтли решил расстаться с ним из-за его клинической депрессии; в 2002 году он подал иск против компании и по решению суда выиграл $7,2 млн (тогда это составило 20% от убытка компании за год).
Флэтли говорит, что это решение было самым тяжелым моментом в его карьере.
Но вскоре, после пузыря, который возник вокруг генных компаний, инвесторы начали терять веру в этот рынок. В 2003 акции Illumina, которые до этого торговались по $22, рухнули до $1. Но именно в этот момент Illumina усовершенствовала свой аппарат, улучшив оптику и химические элементы. В итоге он стал точнее, чем слайдеры Affymetrix. В 2006 году объем продаж Illumina составил $184 млн при $355 млн у Affymetrix. А еще через год Illumina уже была крупнейшим производителем ДНК-микроматриц. Сейчас чипами от Illumina пользуются все — от фермеров (в целях размножения скота) до калифорнийской компании 23andMe, которая консультирует своих клиентов насчет их генетических предрасположенностей. Affymetrix же сейчас стремительно теряет прибыль при рыночной капитализации в $650 млн.
Но Флэтли уже думает наперед и не собирается полагаться на одни микроматрицы. Они способны на моментальное фиксирование, которое определяет только один специфический вариант генов. А что будет, если стоимость расшифровки гена или даже генома человека снизится? Стартап 454 Life Sciences из Коннектикута недавно разработал ДНК-секвенатор, который может расшифровать геном человека не за $100 млн, а за $250 000.
Флэтли заявил совету директоров, что Illumina может по-прежнему почивать на лаврах и подсчитывать барыши, но рано или поздно любая технология становится устаревшей.
Флэтли предложил свое решение: совершить крупное приобретение. В начале 2007 года он потратил $600 млн в акциях (это втрое больше годового объема продаж Illumina) на покупку компании Solexa, разработавшей экспериментальный ДНК-секвенатор, который расщеплял и заново собирал молекулу по мелким элементам в большом масштабе, после чего производилась компьютерная дешифровка результатов. Эта сделка помогла совершить прорыв в отрасли. К 2008 году приборы Illumina с новыми технологиями могли секвенировать геном человека всего за $100 000.
Тем временем конкуренты, среди которых компания LifeTechnologies (с объемом продаж в $4 млрд) и PacificBiosciences (стартап, привлекший $570 млн инвестиций), пытаются отвоевать позиции у Illumina, но пока безуспешно. LifeTechnologies некоторое время назад довольно уверенно вышла на рынок со своей оригинальной технологией, но не смогла удержать динамику продаж.
В PacBio планировали использовать для секвенирования ДНК лазеры, но выяснилось, что у этой технологии слишком высокий процент ошибок, к тому же скорость обработки информации не позволяла конкурировать с наработками Illumina.
«Сегодня сложно найти что-то или кого-то, кто бы мог потеснить их на рынке, — говорит Дэниел МакАртур, генетик из Центральной клиники штата Массачусетс. — Практически все революционные прорывы в этой сфере были совершены с помощью технологий Illumina. Это поразительное достижение».
Успехи Illumina заставали конкурентов врасплох.
Флэтли вспоминает, как в 2010 году встречался с Джонатаном Ротбергом, основателем стартапа «454». Тот продемонстрировал ему ДНК-секвенатор на основе полупроводниковой технологии, который был меньше аналогов и стоил $50 000 — в десять раз меньше приборов Illumina. Флэтли прищурился и поинтересовался, кого Ротберг считает своими конкурентами. «У нас нет конкурентов, — отрезал Ротберг. — Мир вскоре поймет, что лучше этой модели ничего нет».
Звучало амбициозно, но вот только Illumina объявила о собственной новинке по сопоставимой цене всего через несколько недель после того, как компания Ротберга начала работу. Команда Флэтли работала над своим аппаратом с 2008 года, и, хотя LifeTechnologies в итоге купили стартап Ротберга за $725 млн, они все равно не смогли поспеть за Illumina. «Реализация важнее всего остального», — говорит Мустафа Ронаги, изобретатель ключевой технологии определения последовательности ДНК, который сейчас управляет технологиями в Illumina.
Швейцарский фармацевтический гигант Roche осознал, что Illumina недосягаема в тот момент, когда провалились его собственные попытки войти на этот рынок. В декабре 2011 года генеральный директор компании Франц Хумер встретился с Флэтли и объявил ему, что планирует купить Illumina. И лучше, если это будет дружественное поглощение, предупредил Хумер.
Но Хумер еще не знал, с кем имеет дело.
Совет директоров Illumina во главе с Флэтли отверг предложенные Roche $5,7 млрд — они решили, что их недооценивают. Roche перешел в наступление — произошло это в первый день работы финансового директора Illumina Марка Стэпли. «Я наблюдал, как человек, вырастивший компанию за десять лет с нуля, говорит: «Мы поступим так, как будет лучше для акционеров».
Финансисты говорили Флэтли, что это всего лишь вопрос времени, швейцарцев ничто не остановит: незадолго до этого Roche купила лидера биотехнологий Genentech и собиралась проводить экспансию дальше. Однако акционеры встали грудью за Флэтли. Джейсон Янг из Morgan Stanley (третий крупнейший акционер Illumina) заявил, что не продаст свои акции ни за какую цену. Компании-инвесторы тоже продемонстрировали солидарность с Illumina. В итоге Roche пришлось идти на попятную. «Мы получили фантастическую поддержку, — говорит Флэтли. — Нам повезло: несмотря на то что руки у них длинные, карманы у Roche оказались недостаточно глубокими». Сейчас Illumina стоит в четыре раза больше, чем предлагала Roche два года назад.
Roche отступила, а Флэтли пошел дальше — на новые рынки.
Ученые выяснили, что анализ ДНК-маркеров в крови беременной женщины позволяет обнаруживать различные отклонения, в том числе синдром Дауна. В январе 2013 года Illumina приобрела компанию Verinata Health, разработки которой были самыми передовыми в этой области. Уже сейчас доход от продаж перинатальных тестов — около $300 млн, а во всем мире, по мнению аналитиков, он может достичь $3 млрд.
Год спустя Illumina преодолела долгожданный рубеж: запустила X10 — систему, которая может секвенировать геном человека с высокой точностью всего за $1000. Сегодня компания продает эти секвенаторы исключительно партиями по 10 или больше штук на $1 млн в год. Фактически ученые больше не ограничены в своих возможностях и могут исследовать геномы любого количества пациентов. «Инструменты теперь достаточно хороши для того, чтобы мы могли проанализировать гены 10, 20, 30 000 человек», — говорит Эрик Лэндер, директор Института Броуда (BroadInstituteofMIT&Harvard), который приобрел 14 аппаратов у Illumina. Крейг Вентер из компании Human Longevity приобрел 20 аппаратов X10, чтобы разгадать тайну старения. Миллиардер Патрик Синсянь (№101 в глобальном списке миллиардеров , состояние — $12 млрд ) и его Providence Health System (американская сеть из 34 больниц) приобрели 10 аппаратов, чтобы проанализировать гены 22 000 онкологических пациентов, которые к ним обращаются ежегодно.
Технологиями и аппаратами Illumina пользуются компании, которые уже много лет специализируются на генетическом тестировании — Myriad Genetics и Genomic Health. Плюс много новичков, которые жаждут взорвать этот рынок. Так, компания Invitae, созданная основателем GenomicHealth Рэнди Скоттом, предлагает пациентам любой из 3000 генетических тестов за фиксированную цену в $1500. Компания Counsyl из Сан-Франциско использует технологию для определения генетической предрасположенности к раку и для анализов будущих родителей.
Огромные возможности открываются в сфере онкологических исследований, рынок которых может достигать $11 млрд.
Показательна история 60-летней Хезер Фолвайлер. Во время отпуска во Вьетнаме и Камбодже у нее начались головные боли, а потом и проблемы с двигательными функциями в левой половине тела. Когда она вернулась домой, у нее случился судорожный припадок. Приехавшие в 2 часа ночи врачи скорой с помощью компьютерной томографии обнаружили у нее в мозге образование. Опухоль удалили. Однако чуть позже у Фолвайлер нашли еще одну опухоль в кишечнике. Врачи решили, что опухоль слишком велика, чтобы ее можно было удалить, и отправили ее домой. «Я практически опустила руки», — говорит она.
Но один из врачей отправил образец опухоли на генетический анализ в Foundation Medicine — компанию, созданную при поддержке Билла Гейтса и Google Ventures, которая пользуется секвенаторами Illumina для определения мутаций в 236 генах, чтобы максимально эффективно подбирать препараты для лечения. По итогам исследования ей выписали препарат Xalkori от Pfizer, благодаря которому опухоль в кишечнике стала неразличимой и не менялась в размере больше года. «Я чувствую себя так же, как два с половиной года назад», — говорит Фолвайлер.
Направление онкологических исследований для компании — одно из ключевых. Флэтли несколько месяцев убеждал Ричарда Клауснера, бывшего директора Национального института рака (США), занять должность главного медицинского специалиста в Illumina. Как-то за обедом Клаузнер имел неосторожность в порядке дружеского совета предложить схему развития Illumina на будущее. В результате Флэтли сказал ему: «Именно в этом направлении мы и хотим двигаться. Но я не смогу повести компанию туда. А вы сможете».
Следующим прорывом, говорит Клаузнер, станет секвенирование ДНК в раковых клетках или в крови без применения компьютерной томографии. Состояние онкологических пациентов можно будет отслеживать с помощью анализов крови, а в будущем — выявлять болезнь на ранних стадиях. А пока Клаузнер стремится привлечь к сотрудничеству страховые компании, чтобы доказать, что в отличие от большинства других медицинских технологий, улучшение качества диагностирования с помощью секвенирования ДНК приведет к сокращению расходов на здравоохранение, а не к их росту. Диагностика часто становится коммерческой услугой, но Клаузнер уверен, что с секвенированием этого не произойдет.
Другие конкуренты тем временем дышат в затылок. Британская Oxford Nanopore, бывший партнер Illumina, говорит, что работает над созданием секвенаторов размером с флешку; Roche не оставляет попыток и недавно купил стартап Genia Technologies за $350 млн. Но Флэтли уверен, что в сферу влияния Illumina, которая охватывает не только приборы, но также программное обеспечение для работы с данными генетических исследований, никто не сможет вторгнуться в ближайшее время.
С ним сложно не согласиться. Стоимость секвенирования ДНК человека сейчас составляет меньше одной тысячной от уровня 14-летней давности, когда Флэтли приступил к руководству Illumina.
Но компания не собирается останавливаться на достигнутом.
В Illumina рассчитывают снизить цену еще больше.
Директор по технологиям Ронаги вспоминает, что каждый раз, когда с новыми аппаратами Illumina стоимость секвенирования сокращалась в пять-десять раз, на рынке происходило потрясение. Он предсказывает появление секвенаторов ДНК по цене в $10 000 (модели среднего сегмента от Illumina стоят $250 000), что откроет новые рынки и новые возможности для лечения. «У нас довольно ошеломляющие планы на ближайшие три-пять лет», — говорит Флэтли.
Плёвое дело: Где расшифровать ДНК ДНК может рассказать о происхождении человека, предрасположенности к заболеваниям и даже о подходящем виде спорта. The Village составил гид по компаниям, занимающимся популярной генетикой в России

Калифорнийская компания 23andme, созданная Энн Войжитски (бывшая жена сооснователя Google Сергея Брина), перевернула мир генетических исследований и первой предложила по-настоящему доступную расшифровку ДНК. Сейчас за 99 долларов предлагается узнать информацию о собственном происхождении и особенностях организма. Процесс расшифровки ДНК занимает две недели.
Правда, в России 23andme не работает из-за запрета на вывоз биоматериалов за границу, так что выслать почтой пробирку со слюной не получится. Но есть способы обойти запрет: например, можно отправить её из другой страны. В соседней Финляндии такого ограничения нет.
Свои запреты есть в США. С конца 2013 года компания (и её конкуренты) больше не предоставляют информацию о здоровье человека, поскольку правительство запрещает это делать без медицинской лицензии. Введению таких правил способствовал случай, когда 23andme диагностировала американцу смертельное заболевание, а потом оказалось, что это баг.
Много шума наделала и социальная сеть компании. Раньше данные о пользователях туда попадали автоматически, теперь — по желанию пользователей. К пересмотру политики привёл случай, когда распалась супружеская пара. В соцсети выяснилось, что у мужа есть внебрачный ребёнок.
Ещё одно важное последствие обнародования результатов ДНК — это реакция работодателей. Вряд ли при прочих равных они предпочтут кандидата со склонностью к шизофрении. С 2008 года в США действует закон, запрещающий использовать генетическую информацию при приёме на работу. В России подобного ограничения нет.
Но, несмотря на все вопросы, польза от расшифровки ДНК неоспорима. The Village составил список компаний, которые занимаются популярной генетикой в России, и узнал, сколько стоят их услуги.
«Генотек»
От 20 тысяч рублей

Компания выпускников МГУ «Генотек» предлагает либо полную расшифровку генома за 375 тысяч рублей, либо отдельных участков — в зависимости от цели исследования. Например, есть пакет «Генетика красоты» за 24 495 рублей. Клиенту обещают рассказать всё о факторах, влияющих на его внешность, о том, как поддерживать молодость и красоту стоит именно ему. Другой пакет — «Профориентация» — это сочетание психологического теста и анализа ДНК, оно должно выявить, какие сферы деятельности больше всего подходят человеку. Услуга стоит от 30 тысяч рублей. О расовом составе крови и происхождении в «Генотеке» можно узнать за 20 тысяч рублей.
«Генотек» был создан в 2011 году, сейчас это одна из самых известных российских команд на рынке. Интерес к себе они поддерживают во многом благодаря пиару. Например, в рекламных целях делали расшифровку шпионке Анне Чапман и инвестору Александру Галицкому.
500 тысяч долларов, которые компания получила от фонда Rustars Ventures и бизнес-ангелов, давно окупились. По данным газеты «Ведомости», оборот компании в прошлом году составил около одного миллиона долларов.
«Мой ген»
От 30 тысяч рублей

Компания «Мой ген» первой в России занялась массовой расшифровкой генома. Она основана в 2007 году в Екатеринбурге. Сейчас у неё есть представительства в Москве, Санкт-Петербурге и в Перми.
Она предоставляет три основных услуги. Можно заказать данные о здоровье. За 30 тысяч рублей вам расскажут о вашей склонности или устойчивости к болезням. Например, что риск развития болезни Альцгеймера низок, зато нужно быть внимательным к симптомам шизофрении. Также этот пакет включает информацию об эффективности тех или иных лекарств для вашего организма. Один из самых интересных пунктов — это физические данные. Обещают рассказать об уровне IQ, возрасте менопаузы, уровне экстраверсии, вероятности долгожительства и минимальные данные о происхождении.
Тем, кто хочет узнать о своих корнях поподробнее, надо брать пакет «Этно». За те же 30 тысяч рублей вы получите этногенетическую карту. На 15 тысяч рублей дороже стоит общее исследование, в котором будет объединена информация о происхождении и о здоровье.
После того как пробирку со слюной передадут в лабораторию, нужно будет подождать до получения результатов шесть-восемь недель.
«Атлас»

Компания «Атлас» работает в двух направлениях. Первое — это развитие медицинской клиники в Москве, второе — это сервис по расшифровке ДНК. Генетический тест стоит 14 900 рублей. Он включает в себя показатели здоровья (от риска заболеваний до реакции на лекарства), показатели спорта и питания (от оптимальной диеты до оптимального вида спорта), а также информацию о личностных качествах и происхождении. Помимо теста в стоимость услуги входит онлайн-консультация врача-генетика. По результатам пользователь получит рекомендации по всем пунктам с пояснениями.
Как уверяют в самой компании, предложение «Атласа» сейчас самое оптимальное в России по количеству анализируемых показателей и по стоимости. При этом у «Атласа» существенный стартовый капитал, только на разработку внутренней системы хранения и обработки ДНК-информации было потрачено 10 миллионов рублей.
Продажи генетического теста начались в середине сентября.
Lifegen
От 30 тысяч рублей

Lifegen — это американская компания, которая несколько лет назад открыла своё представительство в России. Есть стандартные пакеты c информацией о здоровье, о красоте и о спорте. Также Lifegen делает генетические анализы для пар, собирающихся завести детей. В результатах, которые получат клиенты, будет прогноз о здоровье будущего ребёнка и рекомендации о том, как предотвратить проблемы. Ещё один пакет исследований называется «Мой талантливый ребёнок». Родители получат буклет с информацией по здоровью, талантам и спортивным предрасположенностям чада.
Стоимость услуг начинается от 30 тысяч рублей. Но это минимум информации. За 50–70 тысяч рублей клиенту сделают анализ большего количества участков ДНК и он получит брошюру из минимум 70 страниц про собственное здоровье.
«Одно из наших отличий от других компаний — это форма подачи. Клиент получает книгу про собственное здоровье, — рассказывает управляющий партнёр Lifegen Арсений Духинов. — В ней нет места депрессии. Позитив иллюстраций сглаживает негатив информации. Плюс информация подаётся чётко и понятно. Мы переводим с медицинского на русский».
Духинов признаёт, что цены в американском подразделении компании ниже. Но там и другой рынок. Компании, занимающиеся генетическими тестами, не имеют права предоставлять информацию о здоровье.
MyGenetics
От 4 900 рублей

Новосибирская компания MyGenetics развивается с помощью партнёрской сети. К ней присоединяются желающие заниматься продажами ДНК-тестов и других услуг компании в регионах России и в странах СНГ. На сегодняшний день там одни из самых низких цен на минимальные исследования генотипов. Например, исследование семи генов, в результате которого клиент узнает свой оптимальный вид диеты и уровень метаболизма кофе, стоит 4 900 рублей, то же самое, но с информацией о реакции организма на факторы и продукты среды — 9 900 рублей. Самое полное исследование (28 генов) стоит 14 900 рублей, оно включает расширенную информацию о пищеварении и подходящих видах спорта. Если вы захотите получить результаты в виде книги с глянцевой бумагой, надо будет заплатить вдвое больше. Хотя в таком случае в стоимость включены консультации генетика и диетолога.
Но тем, кому интересно происхождение, стоит обратить внимание на другие сервисы, здесь эта инфомация не включена.


