WAK: искусственная почка стала носимым прибором
23 сентября 2014
Носимая электроника не только облегчает выполнение повседневных задач и открывает новые перспективы в сфере развлечений. Её вклад в развитие медицины становится реально ощутимым с появлением бионических протезов и портативных установок для гемодиализа. Этой осенью в Сиэтле на базе Вашингтонского университета пройдут клинические испытания WAK – первого в мире носимого аппарата класса «искусственная почка».
Проект создан под руководством доктора Виктор Гура (Victor Gura) из Медицинского центра Сидарс-Синай. Воплотить его помогали сотрудники Школы медицины имени Дэвида Геффена при Калифорнийском университете. Этот миниатюрный диализный аппарат достаточно мал и лёгок, чтобы носить его на ремне. Он подключается к пациенту с помощью катетера, позволяя ему двигаться и даже работать с минимальными ограничениями.
 WAK — прототип носимой искусственной почки (фото: Stephen Brashear / hsnewsbeat.uw.edu).
WAK — прототип носимой искусственной почки (фото: Stephen Brashear / hsnewsbeat.uw.edu).
Традиционно гемодиализ выполняется в стационаре и собирает очереди на многие дни. Процедура длится до четырёх часов, а пациент во время неё лежит или сидит практически неподвижно. Множество проблем создаёт нехватка аппаратов, их высокая стоимость и большие габариты. Их требуется одновременно подключать к электросети и системам подачи очищенной воды, поэтому даже мобильная версия обладает размерами с МФУ. Её можно только перевести на тележке из одной оборудованной палаты в другую, но нельзя забрать домой. Показаний к гемодиализу насчитывается довольно много, а людям с тяжёлыми формами почечной недостаточности повторять его приходится регулярно.
Носимая версия WAK (wearable artificial kidney), конечно, уступает по мощности фильтрационным установкам размером со шкаф, но и тактика её применения предлагается совершенно иная. Компактный прибор массой всего четыре с половиной килограмма разрабатывался как персональный. Он работает только с одним пациентом, поэтому не так жёстко ограничен по времени использования. Фильтрация выполняется в фоновом режиме, постоянно поддерживая безопасный уровень токсичных метаболитов в крови.
«Наша команда изобрела устройство, которое отвяжет пациентов от громоздких диализных аппаратов», – написал Виктор Гура на сайте университета. Радикальное уменьшение габаритов стало возможным за счёт использования новых материалов, гибкой электроники и литиевых батарей с высокой плотностью хранения энергии, недавно выпущенных компанией Inspired Energy. Однако главным новшеством стала фильтрационная мембрана, структура которой позволила снизить расход воды на порядки.
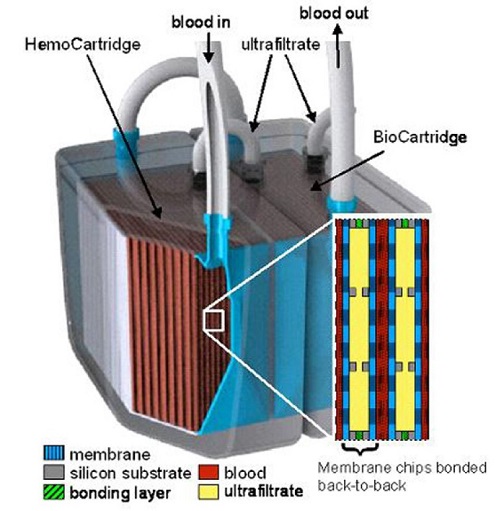
 Устройство носимого диализного аппарата
Устройство носимого диализного аппарата
Какие-то детали её устройства пока не сообщаются. Известно только, что состоит она из двух блоков: основного фильтра в виде трубки посередине устройства и секции из трёх дополнительных элементов округлой формы, закрепляемой слева. Все фильтры меняются ежедневно с соблюдением правил асептики. Основное отличие кроется в объёмах. Обычные аппараты тратят на одну процедуру гемодиализа около ста пятидесяти литров воды. Носимая версия обходится скромным объёмом в половину литра. Такое количество жидкости уже вполне можно носить с собой.
На уровне концепции прибор был представлен ещё в 2009 году. Всё это время разработчики ждали разрешения от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Дело сдвинулось с мёртвой точки только после того, как разработчики выиграли конкурс медицинских инноваций, устроенный самим Управлением. Комиссия признала WAK самым перспективным прибором среди всех разработок, предложенных в тридцати двух номинациях.
Не обошлось в этой истории и без личных знакомств. Один из соавторов разработки профессор Ларри Кесслер (Larry Kessler) в прошлом работал в FDA. Именно он помог команде преодолеть бюрократические заслоны… всего-то за пять лет.
«Исследовательская группа работала в тесном сотрудничестве с FDA, чтобы довести WAK до современного состояния и подготовить его к исследованиям эффективности с участием добровольцев», – прокомментировал доктор Кесслер.
 Разработчики обсуждают WAK. Слева направо: Джонатан Химмельфарб, Виктор Гура и Ларри Кесслер.
Разработчики обсуждают WAK. Слева направо: Джонатан Химмельфарб, Виктор Гура и Ларри Кесслер.
Ускорение процедуры одобрения произошло и потому, что европейские власти оказались более заинтересованными в приборе. Не дожидаясь официального одобрения на тестирование прибора у себя на родине, они разрешили провести ограниченные клинические испытания сперва в Италии, а затем и в Великобритании.
К сожалению, пока речь идёт об очень малой выборке. На первом этапе приборы выдадут шестнадцати пациентам, причём в длительном испытании будут участвовать только десять из них. Добровольцы станут носить компактную искусственную почку двадцать четыре часа в сутки и ежедневно сдавать кровь на анализ в течение месяца.
 Испытания WAK с участием добровольцев.
Испытания WAK с участием добровольцев.
«Концепция переносной искусственной почки была разработана с учётом множества данных, – пояснил директор Института Нефрологии при Вашингтонском университете профессор медицины Джонатан Химмельфарб (Jonathan Himmelfarb). – Среди них лабораторные исследования, компьютерное моделирование и результаты тестов на животных. Теперь у нас появятся и некоторые клинические данные».
Более подробно о процессе создания, возможностях и перспективах первой в мире носимой искусственной почки профессор Химмельфарб рассказывает в этом трёхминутном ролике.
Предварительные лабораторные тесты выглядели весьма оптимистично, однако их недостаточно для внедрения прибора в широкую клиническую практику. Прежде, чем он станет привычным устройством для людей с почечной недостаточностью, пройдут десятки исследований и годы наблюдений.
Если текущая серия испытаний окажется успешной, то команда разработчиков начнёт проектировать ещё более лёгкую и компактную версию прибора. Последующие испытания будут направлены на разработку метода постоянной фоновой фильтрации, который смог бы имитировать естественную работу почки. По мнению авторов проекта, это не только обеспечит более физиологичный режим, но и снизит ограничения диеты.
Портативный протез почки, как альтернатива гемодиализу

Один из действующих прототипов носимой искусственной почки. Фото с сайта www.washington.edu
Не секрет, что миллионы людей на планете страдают от болезней почек. Подавляющее большинство узнают об этом, только когда почки практически отказывают и срочно необходим жизнеспасающий диализ, то есть искусственное очищение крови.
Программный гемодиализ – это значит три раза в неделю на четыре часа пациента подключают к аппарату «искусственная почка» в специализированной клинике или больнице. Таких пациентов в мире 2,5 млн, в России, согласно регистрам, более 30 тыс. Гемодиализ не может заменить все функции природной почки, и постепенно самочувствие больных ухудшается, появляются проблемы с опорно-двигательным аппаратом, сердечно-сосудистой и нервной системами. С годами больные инвалидизируются, теряют трудоспособность, а нередко и преждевременно умирают.
Наилучшей альтернативой диализу является пересадка донорской почки. Однако этот метод подходит не всем, а тем, кому подходит, приходится годами находиться на диализе в ожидании подходящего органа. Потом необходимо всю жизнь принимать дорогостоящие лекарства, угнетающие иммунную систему, для профилактики отторжения пересаженного органа, что повышает риск возникновения опасных для жизни и здоровья инфекций. Не будем уж говорить о сложной психологической стороне пересадки донорских человеческих органов.
За 55 лет применения диализ чрезвычайно усовершенствовался, стал более безопасным, менее дорогим, гораздо более доступным. Тем не менее пациент все равно привязан к аппарату, три дня в неделю вынужден проводить в клинике. Портативная искусственная почка – мечта больных и врачей, с одной стороны, позволила бы избежать поездок пациентов в клинику, с другой – более физиологично удаляла уремические токсины и излишек жидкости, примерно так, как это делают собственные здоровые почки. Похоже, мечта эта приближается к реальности.
Первое подобное устройство, названное WAK (по первым буквам «носимая искусственная почка»), разработанное под руководством профессора В. Гура из Калифорнийского университета Лос-Анджелеса, уже дошло до клинических испытаний в Италии, Великобритании и США. Это первая фаза испытаний, в ходе которой оценивается только безопасность устройства в течение 24 часов. Прототип устройства напоминает широкий пояс, на котором закреплены фильтр, насосы и сменные картриджи с сорбентами. Весит все это около 2 кг и благодаря встроенным подзаряжаемым батареям полностью автономно. Подключается к пациенту при помощи центрального венозного катетера, который нередко устанавливают диализным пациентам в качестве постоянного сосудистого доступа.
Группа исследователей из Италии под руководством профессора Клаудио Ронко из Международного института почечных исследований в Винченце и итальянская биотехнологическая компания RAND предложили использовать вместо пояса жилет WAKman. В нем помещаются и фильтрующее устройство с насосом, и пульт управления, и контрольная панель, и даже два скрытых от глаз мочеприемника. Авторы концепции считают, что устройство может пригодиться также и больным с сердечной недостаточностью и массивными отеками, когда лекарства уже помогают плохо.
Сингапурско-американская компания AWAK в партнерстве со швейцарской Debiotech и датским благотворительным фондом NeoKidney поработали над усовершенствованием сорбента, который помимо активированного угля содержит ионообменные смолы на основе оксида и фосфата циркония, а также иммобилизованный фермент уреазу. Пока удался прорыв в области перитониального диализа: за счет регенерации перитониального раствора сорбентом недельный объем потребляемого раствора уменьшился до 4 л, что очень удобно для путешествующих. Новым устройством уже пользуются первые пациенты.
Над сходным устройством, но уже для гемодиализа серьезно работает большой европейский консорциум Nephron+. В их прототипе WAKD при помощи плазмофильтра происходит постоянная мембранная плазмасепарация. В контур с плазмой встроен особый сорбционный фильтр, состоящий из многослойного наноструктурированного и каталитического адсорбента. Очищенная плазма возвращается в кровоток. По этой технологии не требуется диализат: имеется перистальтический насос, подзаряжаемая батарея, предусмотрена возможность регенерации диализата, общий вес устройства не превышает 2 кг.
Медицинская наука и техника развиваются столь стремительно, что все эти устройства, едва успев внедриться в практику, могут устареть: разрабатывается имплантируемая, или вживляемая, почка, которую хирург в ходе операции под общим наркозом будет вшивать так же, как и донорскую. Преимущества очевидны: нет внешней части катетера – меньше риск инфекции, а риска отторжения нет вообще. Доктора Шуво Рой и Вильям Фиссел из Университета Калифорнии в Сан-Франциско утверждают, что устройство размером чуть меньше обычной кофейной чашки максимально воспроизводит функции почки: помимо гемофильтра имплантируемая почка содержит биореактор, в котором живые канальцевые клетки извлекают полезные вещества из фильтрата первичной мочи, реабсорбируя, к примеру, соль, сахар, как и живая почка, а также вырабатывают важные гормоны, участвующие в регуляции артериального давления, кроветворения и минерально-костного обмена.
Для уменьшения размеров пришлось решить много задач, важнейшая – создание принципиально новой силиконовой мембраны со щелевыми порами по технологии МЕМS, которая впервые использована для биомедицинских целей. В результате свехпроницаемая мембрана компактных размеров с кредитную карточку имеет такую же гидравлическую проницаемость, как стандартный диализатор с полимерной синтетической мембраной.
Исследователи из Сан-Франциско уже объявили набор пациентов в первую фазу клинических исследований, которые запланированы на 2017 год, а пока продолжаются доклинические испытания устройства на крупных животных. Среди спонсоров числится и NASA, полагающее, что данные технологии помогут решить проблему регенерации жидкости на борту космического корабля.
Создан портативный аппарат с функционалом искусственной почки
Способность поддерживать жизнь в людях, обреченных на гибель, — показатель не столько медицинской, сколько социальной защищенности населения. Важнейшую роль в поддержании тяжелобольных людей играют системы очистки крови, освобождающие организм от лишней жидкости, шлаков и токсинов. Вот почему столь актуально создание многофункционального аппарата экстракорпорального (вне организма человека) очищения крови для оказания неотложной помощи при острой интоксикации, длительного жизнеобеспечения пациентов, страдающих острой почечной недостаточностью, а также для коррекции иммунных отклонений. В нашей стране эта задача успешно решена в научно-производственном предприятии “Кортэкс”, образованном в 1991 году при ГосЦНИРТИ группой раработчиков и медиков. Они создали не только многофункциональный, но и, что особенно важно, портативный вариант аппарата “искусственная почка” — “Кортэкс 01/02” для скорой медицинской помощи и санитарной авиации [1—4].
По функциональным возможностям система “Кортэкс” сопоставима с лучшим зарубежным стационарным оборудованием. Она позволяет проводить восемь экстракорпоральных процедур: гемодиализ, гемодиафильтрацию, гемофильтрацию, плазмофильтрацию, каскадную плазмофильтрацию, изолированную ультрафильтрацию, гемосорбцию и плазмоиммуносорбцию*. Существующие за рубежом портативные аппараты искусственной почки (английский Portalysis и японский Niprocurri) выполняют только одну из них. Следует отметить, что в СССР, а теперь и в России не производилась и не производится даже стационарная многофункциональная аппаратура. Не создавалось и оборудование для выполнения таких процедур, как каскадная плазмофильтрация и плазоиммуносорбция.
Конструктивно аппарат “Кортэкс 01/02” выполнен в виде двух блоков — перфузионного и диализного, размещаемых в чемоданах размером 640х420х250 мм каждый (рис.1). Все гидравлические элементы (датчики давления, правильности закладки кровопроводящих магистралей, детекторы воздуха, клапан безопасности, перистальтические одномагистральные насосы крови и антикоагулянта, перистальтический двухмагистральный насос плазмозамещения), а также терминал управления работой аппарата и обеспечения диалогового режима с обслуживающим персоналом расположены на лицевой вертикальной панели перфузионного блока. В верхней торцевой части диализного блока размещен одномагистральный перистальтический насос диализата. Там же находится и первичный источник питания на 50 В. С помощью жесткого сочленения оба блока могут быть объединены в Т-образную конструкцию, разворачиваемую на почти горизонтальной площадке размером около 0,7х1,0 м.
Аппарат представляет собой сложную компьютеризованную систему, работающую под управлением интерактивного программного обеспечения. Он оснащен встроенными центральным процессорным устройством на основе портативного PC/XT-совместимого компьютера с производительностью 106 операций/с и шестью периферийными процессорами (рис.2). Четыре унифицированные платы периферийных процессоров предназначены для регулировки и стабилизации частоты вращения бесколлекторных двигателей ДБМ-120-1-0.4-2Р18 насосов крови, плазмозамещения, диализной жидкости, а также шагового двигателя инфузионного насоса антикоагулянта. Один процессор следит за работой контрольных приборов (датчиков давления в магистралях, детекторов пузырьков воздуха и др.). В блок периферийных процессоров входит и кросс-плата. Мультипроцессорная система и стабилизированные вторичные источники питания встроены в перфузионный блок. Аппарат содержит интерфейсы периферийных процессоров, датчиков давления, температуры, электропроводности жидкости, воздушных пузырьков, накопителей на магнитных дисках, клавиатуры и цветного ЖК-индикатора. Эти устройства выполнены на отечественных микросхемах средней степени интеграции. Для облегчения работы персонала и снижения вероятности ошибок при оперативном вводе информации, клавиатура, расположенная на передней панели аппарата, содержит всего шесть клавишей (“вверх”, “вниз”, “вправо”, “влево”, “сброс” и “ввод”). Помимо отображения вводимой и получаемой в ходе лечебной процедуры информации, а также сообщений медицинскому персоналу в критических и аварийных ситуациях, ЖК-индикатор с разрешением 600х200 пикселей отображает мнемосхемы сборки гидравлических трактов конкретных процедур восстановления гемостаза, входящих в функциональную схему системы.
Промышленные гидравлические узлы аппарата “Кортэкс-01” прошли лабораторно-медицинские испытания в отделении экстракорпоральных методов лечения и трансфузиологии в Медицинском центре Управления делами Президента Российской Федерации. Испытания подтвердили достаточность эксплуатационных параметров для экстракорпоральных процедур, в частности контролируемых путем компьютерного управления фазой бесколлекторных моментных электродвигателей перистальтических насосов расходов перфузата 0,1—1800 мл/мин, инфузата — 0,01—10 мл/ч. Сейчас НПП “Кортэкс” переводит электронную схему “Кортэкс-01” на более дешевую и надежную импортную элементную базу с высокой степенью интеграции.
Диалоговый режим работы, порядок включения и устанавливаемые врачом режимы работы элементов функциональной схемы аппарата задаются специальной программой “Кортэкс 01/02—01”, хранимой в НГМД и содержащей до 12 основных и вспомогательных программных модулей. Модуль 1 предоставляет выбор процедуры из меню с помощью клавиш-стрелок “вверх/вниз”. После выбора конкретной процедуры программа переходит в режим подсказки оператору (модуль 2). На этом этапе на ЖК-индикаторе воспроизводится мнемоническое изображение внешнего вида аппарата и порядок укладки сегментов магистрали на его передней панели. После сборки аппарата программа переходит к предварительной настройке параметров процедуры (модуль 3). Схема экстракорпоральных процедур представлена графически при помощи согласованных с медиками мнемосхем. На этапе настройки оператор устанавливает верхние и нижние пределы и предварительные параметры процедуры (скорость кровотока, подачи антикоагулянта и диализной жидкости, время процедуры и т.п.), а также шаг изменения каждого параметра. Настройка выполняется с помощью соответствующих клавиш-стрелок, перемещаемых вдоль горизонтальных и вертикальных цифровых шкал. По завершении настройки всю информацию можно записать в НГМД, чтобы в дальнейшем использовать ее по умолчанию. Модуль 4 запускает необходимые для данной операции насосы и выводит их на заданные режимы работы. Модуль 5 поддерживает операции вывода необходимой информации и контроля времени процедуры, а модуль 6 периодически опрашивает датчики (контроль текущих параметров процедуры). По желанию персонала параметры можно корректировать (модуль 7).
Причины возникновения аварийной или критической ситуации анализируются и классифицируются как устранимые или неустранимые. К устранимым без прерывания процедуры относится выход отдельного параметра процедуры за пределы разрешенного диапазона (например, давление в возвратной магистрали превышает допустимое значение 200 мм рт. ст.). В этом случае на ЖК-индикатор передаются сообщение о причине аварийной ситуации (модуль 12) и рекомендации по ее устранению (корректировка параметра, необходимые манипуляции и др.). При возникновении неустранимых ситуаций (например, появление в магистрали воздушных пузырьков) ЖК-индикатор воспроизводит соответствующее сообщение и система осуществляет аварийную остановку процедуры (модуль 11). Завершается процедура по желанию оператора или по истечении времени процедуры под управлением модуля 10. Сообщение об этом появляется на экране за пять минут до завершения процедуры. Затем программа возвращается в меню выбора процедур (модуль 1). По желанию оператора можно блокировать аварийные остановки и окончание процедуры по истечении заданного времени. Но в этом случае ответственность за результаты процедуры возлагается на медицинский персонал. Специальная защита программного обеспечения “Кортэкс 01/02-01” от несанкционированного копирования и внесения изменений гарантирует безопасное проведение экстракорпоральных процедур.
Мобильный, быстро разворачиваемый портативный аппарат “Кортэкс 01/02 “ — качественно новый образец медицинской техники, который в равной степени может быть использован в полевых условиях, амбулаторно или стационарно. Он особенно перспективен при оказании экстренной медицинской помощи в труднодоступных регионах с малым числом госпиталей и больниц, оборудованных стационарной аппаратурой для внепочечного очищения крови. Конечно, разработка передовой наукоемкой гемодиализной технологии, создание и промышленное освоение портативного компьютеризованного аппарата “искусственная почка” обходится дорого (в среднем его себестоимость оценивается в 25—27 тыс. долл.). Но эти затраты оправданы огромной потребностью России в аппаратах гемодиализа и плазмофереза. Для организации производства таких аппаратов потребуются инвестиции в размере 1 млн.долл. При объеме выпуска 150—170 аппаратов в год эти средства будут возвращены всего за один год. Нет нужды напоминать, что инвестиции в новые медицинские технологии — “святое дело”. Мы еще не забыли Спитак и Нефтегорск, массовые отравления в Ставрополе и не имеем права лишать своих детей и внуков возможности получить экстренную и эффективную медицинскую помощь при природных и технических катаклизмах.
* Ультрафильтрация — конвекционное освобождение крови от воды и растворенных в ней веществ путем создания повышенного положительного гидростатического давления со стороны крови или разрежения с внешней стороны полупроницаемой мембраны; гемодиафильтрация — процедура одновременной ультрафильтрации и гемодиализа; последовательная ультрафильтрация и гемодиализ — процедура, при которой ультрафильтрация выполняется отдельно от гемодиализа; изолированная ультрафильтрация — ультрафильтрация без последующего гемодиализа; гемофильтрация — конвекционное освобождение крови от растворенных в ней веществ через высокопроницаемые мембраны с компенсацией потерь воды и электролитов специальным физиологическим раствором; гемосорбция (гемоперфузия) — эффективно дополняет гемодиализ, увеличивая степень очищения крови от веществ со средним молекулярным весом при хронической и, возможно, острой почечной недостаточности.
Литература
1. Портативный аппарат для экстракорпоральных процедур восстановления гомеостаза. Решение о выдаче патента по заявке №94029898 (приоритет от 11.08.1994 г.).
2. Портативный аппарат для экстракорпоральных процедур восстановления гомеостаза. Свидетельство РФ на полезную модель N1631 (приоритет от 27.08. 1993 г.).
3. Портативный аппарат для экстракорпоральных процедур восстановления гомеостаза. Патент РФ на промышленный образец N41015 (приоритет от 27. 08.1993 г.).
4. Ведомость технического проекта и пояснительная записка к ОКР “Почка” “Портативная экстракорпоральная система Кортэкс 01/02 для санитарной авиации и скорой медицинской помощи”. КНГЖ. 408732 TII,П3. — М.: ГосЦНИРТИ/НПП “Кортэкс”.
Имплантируемая искусственная почка: обзор сегодняшнего состояния технологии
Трансплантация почек является предпочтительным методом лечения хронических заболеваний почек, но их нехватка, рост числа больных с хроническими заболеваниями этого органа и быстрое развитие заболевания делают большинство пациентов зависящими от диализа. Поскольку диализ резко влияет на образ жизни пациентов, большие надежды возлагаются на развитие искусственных почек, хотя их использование в настоящее время затруднено серьезными опасениями по поводу безопасности. С другой стороны, пациенты с гемодинамической нестабильностью, как правило, не переносят лечение прерывистым диализом из-за их неспособности адаптироваться к изменяющемуся сценарию непредвиденных событий.
Предполагается, что искусственная почка предоставит пациентам с хроническим заболеванием почек новый вариант, выходящий за рамки краткосрочного решения почечного диализа и дорогостоящей пересадки почки. Сегодня разработки в этой сфере ведутся как с целью создания носимого устройств, так и имплантируемого варианта искусственной почки.
В этом обзоре мы обсудим последние достижения в области разработки имплантируемой искусственной почки.
Имплантируемая искусственная почка, которую разрабатывают сегодня несколько коллективов ученых, похожа на существующий экстракорпоральный аппарат почечной помощи, который представляет собой биологически искусственную почку, сочетающую в себе мембранный гемофильтр и биореактор для функционирования в качестве здоровой почки. Однако такое устройство должно быть небольшим, обладать высокой эффективностью фильтрационных мембран, должна быть способна регулировать кровоток и стабилизировать необходимые компоненты. Имплантируемая искусственная почка должна быть способной воспроизводить работу настоящей почки, устранять необходимость в диализе и не требовать постоянного врачебного контроля. Кроме того, ее использование не должно требовать применения иммунодепрессантов и лекарств.
Это в идеале, а что же мы имеем сегодня в действительности?
Kidney Project (Калифорнийский университет в Сан Франциско)

Самая известная разработка в этой сфере ведется в рамках Kidney Project, в котором работают специалисты Калифорнийского университета из Сан-Франциско и университета Вандербильта (США). Они разработали имплантат размером с кофейную чашку, который способен выполнять функции почки и стать великолепным решением для пациентов с хроническим заболеванием почек. Это не очень большое хирургически имплантированное устройство состоит из высокопроницаемого фильтрационного блока и клеток почек человека.
Фильтрующий компонент имеет микропоры, которые могут иметь индивидуальную форму для того, чтобы выполнять определенные задачи. Эти фильтры могут располагаться один за другим, каждый из которых будет выполнять разную функцию фильтрации. Всего устройство содержит в себе пятнадцать таких фильтров, помещенных один поверх другого. Между такими фильтрами и вокруг них находятся живые клетки почки, которые выполняют функции, которые искусственные компоненты выполняют недостаточно хорошо, включая реабсорбцию питательных веществ и избавление от накопленных отходов. Поскольку такое гибридное биологическое устройство будет размещаться вне досягаемости иммунной реакции организма, оно будет таким образом защищено от отторжения человеческим телом.
Т.е. устройство содержит живые клетки, оно теоретически может не только фильтровать кровь, но и выполнять другие важные функции настоящей почки, такие как выделение гормонов для контроля кровяного давления.
Кроме фильтров, которые разделяют различные субстанции в крови, в состав имплантата входит “биореактор”, который обрабатывает ультрафильтрат, выделяет из него сахар и соли, которые возвращает в кровь. В этом процессе вода реабсорбируется также обратно в тело, а ультрафильтрат превращается в “мочу”, которая направляется в мочевой пузырь для удаления из организма. Эти устройства помещены в прочный корпус, покрытый пленкой из материала, который безопасен для использования внутри нашего тела. Имплантат соединен трубками с расположенными рядом венами и мочевым пузырем.
Питание устройство получает за счет давления крови пациента и этот прибор не требует использования внешних трубок или кабелей, которые сегодня ассоциируются с носимой искусственной почкой.
Очищенная кровь возвращается в систему кровообращения через вены, подключенные к имплантату, а отходы перемещаются в мочевой пузырь через соответствующую трубочку. Все элементы, через которые проходит кровь, имеют покрытие, которое должно препятствовать образованию тромбов. Кроме того, образованию тромбов препятствует специальном образом разработанная схема кровотока внутри системы.
По словам разработчиков, устройство не будет выполнять все функции человеческой почки. “Но цель заключается в том, чтобы оно выполняло критически важные функции и было системой, которая после имплантации позволяла пациенту свободно есть и пить, иметь мобильность, лучшее состояние здоровья в целом, и, в отличие от трансплантата, не требовать применения иммунодепрессантов”, – заявляют университетские ученые.
Отметим, что при этом пациенты все равно должны принимать гормональные добавки, которые они используют при прохождении процедур диализа.
Тестирование рабочего прототипа предполагается провести в 2020 году.
USKRC

Недавно компания American Kidney Research Corporation (USKRC) объявила о разработке, как они утверждают, “первой в мире” имплантируемой искусственной почки. В этом устройстве применяется метод производства синтетической мочи с использованием технологии очистки крови с помощью деионизации, которая является первой в своем роде. Он включает в себя процессы фильтрации и ионного транспорта, которые аналогичны процессам, происходящим в человеческой почке.
Разработку, которую финансирует USKRC, ведут ученые из Калифорнийского университета в Лос-Анжелесе и университета Арканзаса.
По словам разработчиков системы,
В крови есть различные ионы и вещества, в том числе натрий, калий, мочевина и вода, которые необходимо транспортировать, либо в кровь, либо в мочевой поток, и в соответствующих количествах в течение определенного периода времени. Для этого необходимо создать ионную транспортную систему и систему транспортировки воды, что мы и сделали. Вот почему мы смогли создать синтетическую мочу.
Прибор включает в себя пару блоков электродеионизации – один предназначен для калия, так как эти уровни необходимы для поддержания электрической активности сердца, а другой – для всех остальных ионов. Он также имеет три других модуля: ультрафильтрации для удержания клеток крови и белков в организме, нанофильтрации для предотвращения выделения глюкозы и модуль обратного осмоса для модуляции количества выделяемой воды.
Система предназначена для удаления мочи со скоростью, сравнимой с той, какую обеспечивает здоровая почка, выдавая примерно то же количество воды, которое потребляется в данный день. Она включает в себя датчики обратной связи и настраиваемое программное обеспечение для контроля изменений в биохимии крови.
Стандартные диализные аппараты подвергают кровь диализату через мембрану; разница между составом диализата и кровью определяет, какие ионы выходят из организма и попадают в диализат. В отличие от диализа, при таком подходе не требуется очищенная вода или диализат, которые усложняют работу врачей и жизнь пациентов.
Недавно прототип такого устройства был испытан на животных, в том числе на свиньях, у которых работа почек очень похожа на функционирование этого органа у человека.
Результаты тестирования показали, что технология позволяет измерять (и, вероятно, в будущем контролировать) уровень калия, удаляемого из крови и затем переносимого в искусственную мочу под контролем компьютера. В настоящее время прототип этого устройства представляет собой носимый прибор размером с небольшой чемодан, который в ближайшем будущем предполагается усовершенствовать, существенно уменьшить, обеспечить его биосовместимость для обеспечения возможности его имплантации в человеческое тело.
По оценкам USKRC, при обеспечении достаточного финансирования испытания на человеке могут быть инициированы через два – два с половиной года.
Причина, по которой эта технология меняет правила игры, говорят разработчики, заключается в способности очищать кровь пациентов с терминальной стадией почечной недостаточности без использования процедур диализа. Это меняет методологию, практикуемую десятилетиями, что приводит к изменению парадигмы.
В ближайшем будущем разработчики планируют дорабатывать каждый из компонентов своего устройства. Он намерены изменить ультрафильтр, чтобы пациенту не понадобился гепарин или антикоагулянт. Кроме того, они планируют перепроектировать ультрафильтр так, чтобы в самом фильтре были компоненты, которые будут препятствовать свертыванию крови и улучшить электродеионизационные узлы.
Qidni Labs

Компания, Qidni Labs создает полностью имплантируемую искусственную почку, которая использует систему нанофильтрации для имитации функции органа. Разработанный специалистами фирмы прототип уже хорошо зарекомендовал себя при имплантации в свиней.
Фильтр устройства изготавливается из ультратонких мембран кристаллического кремния, которые покрываются биосовместимым материалом, чтобы не провоцировать иммунную реакцию. Сегодня такие кремниевые мембраны могут производиться в массовом порядке с размерами пор от 5 до 20 нанометров – достаточно большими, чтобы пропускать частицы отходов, но слишком маленькими для кровяных клеток.
По утверждению разработчиков это устройство будет непрерывно фильтровать кровь пациента в течение многих лет, не требуя обслуживания и очистки, что позволит навсегда освободить пациента от аппаратов диализа.
На базе этой технологии компания также планирует выпустить носимый миниатюрный диализный аппарат, который, по видимости, появится на рынке раньше имплантируемого устройства. В настоящее время Qidni Labs тестирует свои устройства и, если все пойдет по плану, разработчики ожидают, что эти приборы выйдут на рынок через четыре-пять лет.
Сейчас проект находится на доклинической стадии.
Выращенные в лаборатории живые почки
Несколько исследователей по всему миру пытаются вырастить полноценную почку человека с помощью почечных клеток от эмбрионов, стволовых клеток, взятых от взрослых людей, или клонированной ткани. В частности, команда ученых из Манчестерского университета первой в мире научилась выращивает части почки (нефроны), которые фильтруют кровь, в лаборатории с использованием человеческих стволовых клеток. Выращенные таким образом нефроны затем были имплантированы в мышь и показали свою способность фильтровать кровь и вырабатывать мочу, подобно тому, как работает нормальная почка. Новые структуры содержали большинство составных частей, присутствующих в нефронах человека – в том числе проксимальные канальцы, дистальные канальцы, капсулу Боумана и петлю Хенле.
При здоровых почках, имеющих около 1 миллиона нефронов каждая, процесс должен был бы масштабироваться, чтобы вырастить целые органы, готовые к трансплантации. Достоинство использования собственных стволовых клеток пациента заключается в том, что это может помочь избежать отторжения его организмом выращенной в лаборатории почки (что может произойти с сегодняшними пересадками почек).
Это исследование находится в самом начале, и требуется еще очень много работы, но способность выращивать нефроны в лаборатории уже является выдающимся достижением.
Испытания экспериментального образца носимого аппарата «искусственная почка »
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Аннотация
Цель. В статье представлены результаты медико-биологических испытаний носимого аппарата «искусственная почка» на основе перитонеального диализа с постоянной регенерацией диализирующего раствора.
Материалы и методы. Испытания проводились на собаке весом 15 кг. На первом этапе проводился диализ собаке с работающими почками для оценки влияния аппарата на биохимические параметры крови. На втором этапе собаке введено 200 мл рентгеноконтрастного вещества, для того чтобы вызвать острую почечную недостаточность.
Результаты. В ходе испытаний аппарат производил непрерывный перитонеальный диализ с регенерацией диализного раствора в течение 39,5 часа. За время второго этапа (34 часа) из диализирующего раствора удалялся креатинин и мочевая кислота со скоростью 0,3 мг/ч и мочевина со скоростью 0,15 г/ч, общий объем удаленного ультрафильтрата составил 350 мл. По окончании второго этапа испытаний биохимические показатели крови стабилизировались до нормальных значений.
Заключение. Разработанный аппарат позволяет производить искусственное очищение крови с ультрафильтрацией, не оказывая патологического воздействия на биохимические показатели крови.
Ключевые слова
Об авторах
Адрес: 124498, Москва, г. Зеленоград, площадь Шокина, д. 1. Тел. (925) 049-14-54
Список литературы
1. Armignacco P, Garzotto F, Neri M, Lorenzin A, Ronco C. WAK Engineering Evolution. Blood Purification. 2015; 39 (1–3): 110–114. doi: 10.1159/000368955. PMID: 25659421.
2. Ronco C, Fecondini L. The Vicenza Wearable Artificial Kidney for Peritoneal Dialysis (ViWAK PD). Blood Purification. 2007 Mar; 25 (4): 383–388. doi: 10.1159/000107775. PMID: 17785968.
3. Nikitidou O, Peppa VI, Leivaditis K, Eleftheriadis T, Zarogiannis SG, Liakopoulos V. Animal models in peritoneal dialysis. Frontiers in Physiology. 2015 Jan; 6. doi: 10.3389/fphys.2015.00244. PMID: 26388781.
4. Wieczorowska-Tobis K, Breborowicz A, Pawlaczyk K, Kuzlan-Pawlaczyk M, Polubinska A, Oreopoulo DG. Animal models for peritoneal dialysis. Peritoneal dialysis international. 1999; 19 (Suppl. 2): S189–S192. PMID: 10406517.
5. European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) Clinical Practice Guidelines on Acute Kidney Injury: Part 1: definitions, conservative management and contrast-induced nephropathy. The ad- hoc working group of ERBP: D. Fliser, M. Laville, A. Covic et al. Nephrol. Dial. Transplant. 2012; 27 (12): 4263–4272.
6. Newhouse JH, Kho D, Rao QA, Starren J. Frequency of serum creatinine changes in the absence of iodinated contrast material: implications for studies of contrast nephrotoxicity. Am. J. Roentgenol. 2008 Aug; 191 (2): 376–382.
Для цитирования:
Базаев Н.А., Гринвальд В.М., Селищев С.В., Калинов А.В., Козачук А.В., Косаткин В.В., Тюндер Ф.Ф., Федерякин Д.В. Испытания экспериментального образца носимого аппарата «искусственная почка ». Вестник трансплантологии и искусственных органов. 2017;19(3):46-52. https://doi.org/10.15825/1995-1191-2017-3-46-52
For citation:
Bazaev N.A., Grinvald V.M., Selishchev S.V., Kalinov A.V., Kozachuk A.V., Kosatkin V.V., Tyunder F.F., Federyakin D.V. Exp erimental research of wearable artificial kidney. Russian Journal of Transplantology and Artificial Organs. 2017;19(3):46-52. (In Russ.) https://doi.org/10.15825/1995-1191-2017-3-46-52

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Высокопоточный высокоэффективный гемодиализ
Удаление токсинов в более широком диапазоне молекулярной массы.
Высокопоточный диализ имеет преимущества для жизни пациентов, особенно, при средне- и долгосрочном применении. Однако для успешного применения высокопоточного диализа требуется диализный аппарат с контролируемой ультрафильтрацией, совершенная система для приготовления воды и контроля ее качества, а также специальные высокопоточные диализаторы – фильтры.
Фильтры имеют несколько больший диаметр пор, поэтому их применение позволяет улучшить удаление более крупных молекул. Для форсированного удаления токсинов также повышают давление внутри капилляра. Очень важно правильно подобрать диализный фильтр. Диализные фильтры различаются количеством и типом капилляров, методом стерилизации, диаметром пор, а также, что немаловажно, материалом мембраны.
Немало сделано для того, чтобы диализный фильтр как можно меньше отличался от почки по своим фильтрующим свойствам.
Кто делает процедуру
Истории наших пациентов
Вопрос-ответ
Гемодиализ — это медицинский метод очищения крови от токсинов (ядов), с помощью
аппарата «Искусственная почка». Благодаря этой методике становится возможным
спасение даже практически безнадёжных больных. Как и любой другой метод лечения,
гемодиализ имеет положительные и отрицательные стороны. Перед назначением этой
процедуры доктора обязательно взвешивают все за и против, прежде чем принять
окончательное решение. Иногда больному может понадобиться работа с психотерапевтом,
чтобы изменить отношение к гемодиализу.
Хроническая почечная недостаточность – это не приговор. Современное медицинское
оборудование и лекарственные препараты позволяют практически полностью замещать
утраченные почечные функции. Врач обязательно подберет лучший план дальнейшей
терапии и оптимальную программу гемодиализного лечения, с учетом всех изменений со
стороны организма. Конечно, пациент должен придерживаться определенных правил при
самостоятельном наблюдении дома и диетических ограничений, о которых расскажет
лечащий врач. Прежде чем приступить к осуществлению гемодиализа, всегда решается
вопрос о сосудистом доступе:
Чаще других используют АВ (артериовенозную) или нативную фистулу, которая
«созревает» и «живет» довольно продолжительное время, соединяя венозный и
артериальный сосуды пациента, обычно, на левом предплечье;
Если вены больного не обладают качествами, способными обеспечить создание
полноценной фистулы, устанавливают синтетический сосудистый протез,
располагая его подкожно, подобно собственным сосудам;
В иных случаях, когда «промедление смерти подобно», пациенту в центральную
вену вводят силиконовую трубку, которая называется центральным венозным
катетером.
Пациент располагается в специальном удобном кресле, предназначенном для
гемодиализа;
Связующим звеном между пациентом и устройством для очищения крови вне организма,
которое называют «искусственной почкой» или гемодиализатором, является один из трех
описанных выше сосудистых доступов (чаще – АВ-фистула);
Кровь из артерии движется в аппарат, состоящий из двух независимых частей,
разделенных мембраной, которая имеет избирательную пропускную способность и
предназначена для того, чтобы отмежевать очищаемую биологическую жидкость (кровь)
от жидкости очищающей (диализата). Проницаемость мембраны зависит от характеристик
ее пор. Например, немалым по размерам форменным элементам крови, протеинам и
другим полезным компонентам не так-то легко «протиснуться» через поры, зато «отходы
производства» (мочевина, отработанная вода, некоторые элементы) свободно покидают
кровь через мембрану;
В диализирующую жидкость, подчиняясь осмотическим силам, из крови направляются
молекулы продуктов метаболизма, а из диализата для восполнения потерь поступают
полезные вещества (электролиты, углеводы, бикарбонаты), которые стремятся к месту
назначения (кровеносные пути). Кровь и очищающий раствор в системе существуют
изолированно друг от друга, то есть, никак не перемешивается;
Для того, чтобы кровь не сворачивалась во время искусственной фильтрации и больного
не настигли тромбоэмболические осложнения, при проведении гемодиализа
применяется антикоагулянтное средство (гепарин), которое непосредственно вводится в
систему;
Чистая, обновленная биологическая среда (кровь) возвращается в свое привычное русло, а
диализирующая жидкость, выполнив свою задачу по очистке и вобрав в себя ненужные
организму вещества (токсины, воду), благополучно покидает аппарат, собираясь в
емкости для отработанного раствора.
Обычный режим гемодиализа – три процедуры в неделю, если не возникает
необходимость проводить его чаще. Большинство пациентов гемодиализ переносят
хорошо, никаких негативных ощущений не отмечают. Лишь у некоторых больных
наблюдается снижение артериального давления, которое дает типичные для подобных
случаев симптомы (головокружение, головная боль, тошнота, рвота).
Качественный гемодиализ, выполненный высокопрофессиональной медсестрой по
программе, разработанной опытным врачом переносится обычным пациентом без особых
тягот и осложнений.
Однако бывают и проблемы: артериальное давление может понижаться и повышаться во
время процедуры, в конце процедуры и после нее пациент может ощущать головную боль,
вялость, слабость, усталость. Так как во время процедуры вводятся антикоагулянты, то в
процессе процедуры и после нее возможны геморрагические осложнения. Еще одна
группа осложнений возможна в связи с пункциями артерио-венозной фистулы, в месте
уколов могут возникать гематомы. Подробно все возможные осложнения гемодиализа
изложены в “Информированном согласии”, которое подписывает пациент перед началом
диализа. Это довольно жесткий документ, так как там перечислены ВСЕ возможные
осложнения, в том числе смертельные. Но человек должен знать правду.
Элементы Пельтье или бесплатное электричество от костра
При помощи простых приспособлений можно использовать теплопотери от нагревания воздуха или жидкостей. В этой статье мы расскажем, как использовать бросовую энергию печей, котлов и открытого огня, преобразовав её в постоянный электрический ток небольшой силы.
- Конструкция термоэлектрического модуля
- Собираем ТЭМ на 5 В
- Энергопечь

Любой химический процесс проходит с выделением разного рода энергии. Такой мощный источник, как горение использовался во все времена. Его можно назвать первичным источником тепла и света. Горят практически все вещества на Земле, выделяя при этом тепло и свет в разных количествах. Преобразовать тепловую энергию в электрическую — дело несложное, если под рукой есть рабочая паротурбина, подобная тем, что установлены на ТЭЦ. Это громоздкое и сложное устройство, которому вряд ли найдётся место в котельной загородного дома. Мы попробуем извлечь пользу из выделения тепла при печном отоплении или нагревании воды.
Эффект Пельтье — это явление перепада температур при взаимодействии термопар двух различных типов проводников (p-типа и n-типа) при прохождении через них постоянного тока. Эффект Зеебека — следствие эффекта Пельтье, когда при нагревании одной из термопар образуется электрический ток. Мы не будем подробно описывать термодинамику процесса — эту сложную для восприятия информацию можно легко найти в справочной литературе. Нас интересует результат и варианты его практического использования.
Конструкция термоэлектрического модуля
Термоэлектрический модуль (ТЭМ) состоит из множества термопар, соединённых между собой медной пластиной. Поле термопар вклеивается между двух керамических пластин. Собрать такой модуль возможно только в заводских условиях. Но скомпоновать несколько ТЭМ для собственных нужд получится и дома. Элементы Пельтье-Зеебека имеются в свободной продаже в специализированных магазинах (и на сайтах) по продаже технологического оборудования.
Собираем ТЭМ на 5 В
- модуль Пельтье TEC1–12705 (40×40) — 2 шт.;
- повышающий преобразователь постоянного напряжения ЕК-1674;
- лист дюралюминия толщиной 3 мм;
- ёмкость для воды с идеально ровным дном (ковш);
- термоклей;
- паяльник.

Вырезаем из листа дюралюминия две одинаковые пластины, размерами чуть более двух модулей, лежащих рядом. Укрепляем термоклеем пластины на модулях с обеих сторон. Фиксируем (термоклеем) получившийся «сэндвич» на дно ковша. Такую конструкцию уже можно ставить на огонь, но мы получим на выходе бесполезные 1,5 В. Для улучшения характеристик нам и нужен повышающий преобразователь, который мы впаиваем в цепь. Он повысит напряжение до 5 В, а этого уже достаточно для зарядки мобильного телефона.

Внимание! Преобразователь имеет размеры 1,5х1,5 см. При отсутствии профессиональных навыков доверьте пайку специалисту.
Разность температур в нашей конструкции получается за счёт нагрева одной стороны (от печи или пламени) и охлаждения другой (вода в ковше). Разумеется, чем больше разница, тем эффективнее работа модуля. Поэтому, для работы в режиме микрогенератора понадобится сравнительно низкая температура воды в ковше (её лучше периодически заменять). Для выработки заветных 5 В достаточно поставить конструкцию на стакан с горящей свечой.
Пропорционально комбинируя большее количество модулей, мы получим более эффективную систему выработки энергии. Соответственно, увеличивая конструкцию, пропорционально увеличиваем теплообменник. При этом охлаждаемая поверхность должна быть полностью покрыта ёмкостью с водой (самый простой и доступный вариант).
Всё так просто, что сразу возникает желание собрать побольше модулей в одну систему и вырабатывать 220 В из костра. А потом подключить масляный обогреватель или кондиционер. Такая простая система имеет свои недостатки, и главный из них — низкий КПД. Обычно этот показатель не превышает 5%. Это обуславливает сравнительно малую силу тока 0,5 — 0,8 А и очень малую мощность — до 4 Вт.
Для насоса или лампы накаливания это ничтожно мало, но вполне достаточно для:
- зарядки аккумуляторов вплоть до мотоциклетных (в вариантах, пропорциональных требованиям);
- работы светодиодных (LED) ламп;
- радиоприёмника.
В зимнее время система, помещённая на источник тепла, находящийся на улице, будет работать максимально эффективно.
Затраты на материалы для сборки термоэлектрического микрогенератора на 5 В:
| Наименование | Цена, руб. | Примечание |
| Модуль Пельтье TEC1–12705 (40×40)* — 2 шт. | 600 | Цена за 2 шт. |
| Повышающий преобразователь постоянного напряжения ЕК-1674 | 320 | |
| Дюралюминий | 300 | Лист для варианта с ковшом |
| Термоклей Radial | 150 | 2 мл |
| Ковш | 100 | Новый |
| Итого на материалы | 1470 |
*- данная модель элемента выбрана из соображений цены. Ассортимент ТЭМ у фирм-поставщиков довольно широк, что позволяет подобрать более производительные (до 8 В) модели (они ощутимо дороже).
Заводские изделия подобной конструкции только начинают появляться в продаже. Серийное производство ведётся мелкими партиями, да и ассортимент невелик. Стоимость такого «ковшика» стартует с 2500 руб.

Заводской термогенератор — устройство, основанное на эффекте Пельтье-Зеебека, которое можно закрепить прямо на разогретую поверхность. От конструкции, описанной выше, его отличает заводское исполнение (а значит, надёжность), отсутствие жидкостного теплообменника (вместо него — рёбра для воздушного охлаждения) и более высокая цена.

Стандартный «походный» термогенератор имеет следующие характеристики:
| Напряжение | 13,5 В |
| Сила тока | 0,16 А |
| Мощность | 2,2 Вт |
| Вес | 1,6–2 кг |
| Кабель в бронерукаве | Да |
| Защита от перегрева | Да |
| Набор стандартных разъемов | Да |
| Размеры (примерно) | 150х150х200 мм |
| Цена | От 7000 руб. |
Как видно из таблицы, заводская надёжность и утилитарность обходится недёшево. При этом нельзя сказать, что он функционально превосходит самодельный вариант с ковшом. Впечатляющие 13,5 В ускорят зарядку мобильника, но для этого будет нужно носить с собой 2 кг веса в походе, а это непозволительная роскошь (с учётом размеров прибора). Ну и, конечно, цена заставляет задуматься. На эту сумму можно собрать уже не «термоковшик», а «термокастрюлю» и спокойно заряжать ноутбук. И ещё один нюанс — прибор всё равно требует закрепления на металлической пластине в случае использования открытого огня.
В целом это приятное и удобное дополнение для тех, у кого нет проблем с деньгами и свободным местом в багажнике.
Энергопечь
На сегодняшний день энергопечь — апофеоз применения ТЭМ в быту. Это заводское изделие, по сути дела топка-«буржуйка», для любого вида твёрдого топлива с интегрированным теплоэлектрическим модулем. Идеальный вариант для охотничьих домиков, дач, отдалённых зимовок и вообще любого вида жизни вдали от цивилизации. Рассчитана на автономное использование (без периферических теплоотводов), имеет только очаг и дымоход. Предусматривает приготовление пищи. На эту печь устанавливают самые мощные элементы Пельтье-Зеебека.

| Выходная мощность | 25–50 Вт |
| Выходное напряжение | 12 В |
| Объём топки | 30–60 литров |
| Вес | 30–60 кг |
| Тепловая мощность | 4–6 кВт |
| Стабилизатор | Да |
| Заводские разъёмы | Да |
| Защита от перегрева | Да |
| Цена | 23000–40000 руб. |
Хотя печь и переносная, безусловно, это «супертяжёлая весовая категория» среди бытовых приборов. Однако и спектр задач у энергопечи довольно широк — она может заряжать даже автомобильные аккумуляторы, освещать LED лампами целые комнаты. Ей найдётся место в экспедиционном обозе и в охотничьем вездеходе, в техническом помещении и на даче. Иными словами, в этом случае источник тепла у нас всегда с собой, осталось найти топливо.
В своей нише энергопечь незаменима, хотя и немного настораживает заявленный производителем срок службы — 10 лет. Следует отметить, что, как и в термогенераторе, есть возможность профилактической (или аварийной) замены всех деталей вплоть до корпуса.
Термоэлектрические модули — крайне занятные объекты. Помимо описанных методов применения их также используют для кондиционирования воды и воздуха. При этом на такой же элемент подаётся постоянный ток и он работает «в обратную сторону» — охлаждает воздух. Эта технология с успехом применяется в автомобильных кондиционерах и кулерах для воды, в автомобилестроении и при производстве микропроцессоров. Мы опишем эти устройства в следующей статье.

